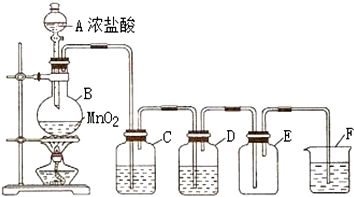
题目内容
5.下列说法正确的是( )| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 离子化合物中只含有离子键 | |
| D. | 化学键断裂的变化一定是化学变化 |
分析 A、含有共价键的化合物不一定是共价化合物,如NaOH中,O-H键为共价键,但为离子化合物;
B、只含共价键的化合物叫共价化合物;
C、离子化合物中可能含共价键;
D、有化学键断裂的变化不一定有化学键的生成.
解答 解:A、含有共价键的化合物不一定是共价化合物,如NaOH中,O-H键为共价键,但为离子化合物,所以只含共价键的化合物叫共价化合物,故A错误;
B、只含共价键的化合物叫共价化合物,所以在共价化合物中一定含有共价键,故B正确;
C、离子化合物中可能含共价键,如离子化合物氢氧化钠中既含离子键也含共价键,故C错误;
D、如HCl溶于水共价键断裂,但不是化学变化,故D错误;
故选B.
点评 本题考查共价键与离子键、离子化合物与共价化合物的区别,题目难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
2.1-乙炔基-1-环己醇可用作加成型硅橡胶储存稳定剂、硅氢加成反应抑制剂,还可用作油墨、油漆以及涂料的催干剂等,其结构如图所示: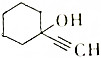 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮( 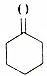 ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
 将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(
将干燥的乙炔通入液氨中,同时加入钠,并滴加环己酮(  ),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )
),若原料完全反应生成1-乙炔基-1-环己醇,则乙炔与环己酮的质量之比应是( )| A. | 1:1 | B. | 1:2 | C. | 13:49 | D. | 24:49 |
9.某研究性学习小组探究化学反应速率和限度设计并完成下列实验.
请回答下列问题:
(1)实验Ⅰ的目的是探究浓度对化学反率速率的影响,反应的离子方程式是2Al+6H+=2Al3++3H2↑
(2)实验Ⅱ的目的是探究反应物接触面积对反应速率的影响,实验中将块状碳酸钙加入试管中的方法是先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破
(3)实验Ⅲ中观察到的现象是①中颜色浅,②中颜色深,由此得出的结论是降温平衡向放热方向移动,升温平衡向吸热方向移动.
| 实验 | 编号 | 实验温度/℃ | 药品 | |
| Ⅰ | ① | 25 | 铝条 | 盐酸5ml3mol•L-1 |
| ② | 25 | 铝条(规格同上) | 盐酸5ml0.5mol•L-1 | |
| Ⅱ | ① | 25 | 碳酸钙粉末 | 盐酸5ml3mol•L-1 |
| ② | 25 | 块状碳酸钙 | 盐酸5ml3mol•L-1 | |
| Ⅲ | ① | 5 | 二氧化氮与四氧化二氮的混合气体 | |
| ② | 35 | 二氧化氮与四氧化二氮的混合气体 | ||
(1)实验Ⅰ的目的是探究浓度对化学反率速率的影响,反应的离子方程式是2Al+6H+=2Al3++3H2↑
(2)实验Ⅱ的目的是探究反应物接触面积对反应速率的影响,实验中将块状碳酸钙加入试管中的方法是先将试管横放,用药匙或镊子将药品放在试管口,再将试管慢慢竖起,使药品缓缓的滑到试管底部,防止将试管砸破
(3)实验Ⅲ中观察到的现象是①中颜色浅,②中颜色深,由此得出的结论是降温平衡向放热方向移动,升温平衡向吸热方向移动.
10.工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2•6H2O晶体,其工艺流程为:
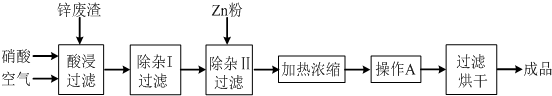
有关氢氧化物开始沉淀和沉淀完全的pH如表:
(1)在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是适当升高反应温度(或增大硝酸浓度、将锌废渣粉碎等).(至少写出一个措施)
(2)上述工艺流程中多处涉及“过滤”,过滤时洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.调节pH所用X可以选用AB.
A.ZnO B.ZnCO3 C.H2SO4 D.HNO3
检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却结晶.

有关氢氧化物开始沉淀和沉淀完全的pH如表:
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
(2)上述工艺流程中多处涉及“过滤”,过滤时洗涤沉淀的操作是沿着玻璃棒向过滤器注入蒸馏水浸没沉淀,水自然流下,重复2~3次.
(3)在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为5.2~5.4.调节pH所用X可以选用AB.
A.ZnO B.ZnCO3 C.H2SO4 D.HNO3
检验Fe3+是否沉淀完全的实验操作是静置片刻,取少量上层清液,滴加KSCN溶液,若不出现血红色,表明Fe3+沉淀完全.
(4)加入Zn粉的作用是除去溶液中的Cu2+.“操作A”的名称是冷却结晶.
14.为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格.
供选择的化学试剂及实验方法A.将气体通入盛有NaOH溶液的洗气瓶B.取样,滴加KSCN溶液C.取样,滴加酚酞试液D.取样,灼烧.
| 实验 目 的 | 试剂及方法 |
| 鉴别丝绸和棉布 | |
| 除去CO中混有少量CO2 | |
| 证明Na2CO3溶液呈碱性 | |
| 检验溶液中是否含Fe3+ |
 2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得:
2011年9月29日我国成功发射的“天宫一号”飞行器的外壳覆盖了一种新型结构陶瓷材料,其主要成分是氮化硅,该陶瓷材料可由石英固体与焦炭颗粒在高温的氮气流中通过如下反应制得: .
.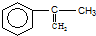 出发来合成A,其合成路线如下:
出发来合成A,其合成路线如下: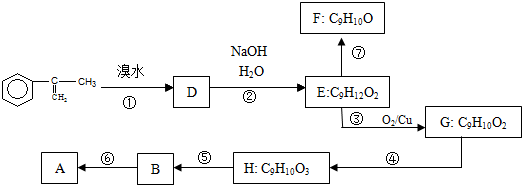
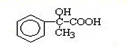
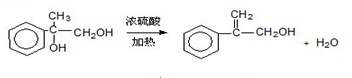 .两分子H之间发生反应生成六元环酯化学方程式是:2
.两分子H之间发生反应生成六元环酯化学方程式是:2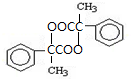 +2H2O.
+2H2O.
 .
.