题目内容
某校学生课外活动小组为了探究SO2的性质及碳、硅的非金属性强弱,设计下列实验装置进行实验,请回答下列问题.(a、b为弹簧夹,夹持、加热及固定装置已省略)
1.探究碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)
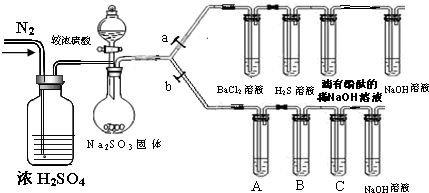
(1)实验主要操作步骤:①连接仪器、② 、③加药品后,关闭a 打开b,④ 、⑤然后滴入较浓硫酸,⑥加热.
(2)设置步骤④的目的是 .
(3)园底烧瓶中反应的化学方程式是 .
(4)装置A、B、C中试剂分别是 .
(5)能说明碳的非金属性比硅强的实验现象是 .
2.验证SO2的氧化性、还原性和酸性氧化物的通性.
(1)在1小题(1)的第③步操作是 .
(2)滴有酚酞的氢氧化钠溶液的作用是 滴有酚酞的氢氧化钠溶液的作用是 .
(3)验证SO2具有氧化性的实验现象是 ,化学方程式是 .
(4)BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
写出其中SO2显示还原性生成沉淀的离子方程式 .
1.探究碳、硅非金属性的相对强弱.(已知酸性:亚硫酸>碳酸)

(1)实验主要操作步骤:①连接仪器、②
(2)设置步骤④的目的是
(3)园底烧瓶中反应的化学方程式是
(4)装置A、B、C中试剂分别是
(5)能说明碳的非金属性比硅强的实验现象是
2.验证SO2的氧化性、还原性和酸性氧化物的通性.
(1)在1小题(1)的第③步操作是
(2)滴有酚酞的氢氧化钠溶液的作用是
(3)验证SO2具有氧化性的实验现象是
(4)BaCl2溶液中无明显现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置.
| 滴加的溶液 | 溴水 | 氨水 |
| 沉淀的化学式 |
考点:性质实验方案的设计
专题:实验题
分析:1.(1)连接好装置后,必须进行检查装置气密性是否良好,否则影响实验测定且污染环境;产生二氧化硫的反应开始前应该排尽装置中的空气,防止空气中的CO2对实验产生影响;
(2)装置内的空气中含有的二氧化碳影响测定结果,需要排除装置中二氧化碳;
(3)硫酸的酸性大于亚硫酸,实验圆底烧瓶中亚硫酸钠与硫酸反应生成二氧化硫气体;
(4)根据实验目的“探究碳、硅非金属性的相对强弱”及常见物质的性质选择试剂,注意试管B用于除去二氧化硫,应该选用酸性高锰酸钾溶液;
(5)二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强;
2.(1)验证SO2的氧化性、还原性和酸性氧化物的通性,需要用到硫化氢溶液、滴有酚酞的氢氧化钠溶液的试管,据此判断操作方法;
(2)根据二氧化硫与氢氧化钠溶液发生中和反应分析;二氧化硫有毒,多余的气体应该用氢氧化钠溶液吸收,避免污染大气;
(3)硫化氢溶液中出现浅黄色浑浊现象,证明生成硫单质,从而说明二氧化硫具有氧化性,二氧化硫与硫化氢反应生成硫单质;
(4)溴水具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀.
(2)装置内的空气中含有的二氧化碳影响测定结果,需要排除装置中二氧化碳;
(3)硫酸的酸性大于亚硫酸,实验圆底烧瓶中亚硫酸钠与硫酸反应生成二氧化硫气体;
(4)根据实验目的“探究碳、硅非金属性的相对强弱”及常见物质的性质选择试剂,注意试管B用于除去二氧化硫,应该选用酸性高锰酸钾溶液;
(5)二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强;
2.(1)验证SO2的氧化性、还原性和酸性氧化物的通性,需要用到硫化氢溶液、滴有酚酞的氢氧化钠溶液的试管,据此判断操作方法;
(2)根据二氧化硫与氢氧化钠溶液发生中和反应分析;二氧化硫有毒,多余的气体应该用氢氧化钠溶液吸收,避免污染大气;
(3)硫化氢溶液中出现浅黄色浑浊现象,证明生成硫单质,从而说明二氧化硫具有氧化性,二氧化硫与硫化氢反应生成硫单质;
(4)溴水具有氧化性,能将二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成硫酸钡沉淀;另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸根离子和钡离子反应生成亚硫酸钡沉淀.
解答:
解:1.(1)装置气密性是否良好将严重影响实验测定,且二氧化硫有毒,因此连接完装置后应该先检查装置气密性,然后再装入药品;由于空气中二氧化碳影响实验效果,所以反应开始前应该先通入一段时间的氮气,
故答案为:检查装置气密性;通入N2气一段时间然后关闭;
(2)由于空气中的二氧化碳对实验会产生影响,则实验前应该通入N2气一段时间,以便排尽装置中的空气,
故答案为:排尽装置中的空气,防止空气中的CO2对实验产生影响;
(3)圆底烧瓶中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(4)实验的目的是检验碳、硅非金属性的相对强弱,所以试管A应该为产生二氧化碳装置,盛放的试剂为饱和碳酸钠溶液;试管B是除去二氧化硫的装置,避免二氧化硫影响性质检验,可以用酸性高锰酸钾溶液;试管C证明碳酸酸性大于硅酸,应该盛放硅酸钠溶液,
故答案为:饱和NaHCO3溶液、酸性KMnO4溶液、Na2SiO3溶液;
(5)二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管C中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:试管C中出现白色胶状沉淀;
2.(1)验证SO2的氧化性、还原性和酸性氧化物的通性,需要选用第一排试管中试剂,所以操作方法为:打开a,关闭b,
故答案为:打开a,关闭b;
(2)二氧化硫能够与氢氧化钠溶液发生中和反应,滴有酚酞的氢氧化钠溶液与二氧化硫反应后溶液变成无色,从而证明二氧化硫具有酸性氧化物的通性;
最后的试管中盛放的氢氧化钠溶液是用于吸收多余的二氧化硫,否则污染空气,
故答案为:验证SO2具有酸性氧化物的通性;除去剩余SO2气体,防止污染空气;
(3)硫化氢与二氧化硫能够发生氧化还原反应生成S单质,盛有H2S溶液的试管中出现浅黄色浑浊现象,说明生成了S单质,二氧化硫中硫元素的化合价从+4价变为0价,表现了氧化性,反应的化学方程式为:SO2+2H2S=3S↓+2H2O,
故答案为:H2S溶液中有浅黄色浑浊出现;SO2+2H2S=3S↓+2H2O;
(4)BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,溴水中有氯气分子,溴水具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成BaSO4白色沉淀,反应的方程式为:SO2+Br2+Ba2++2H2O=BaSO4↓+2Br-+4H+;另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成BaSO3,
故答案为:
;SO2+Br2+Ba2++2H2O=BaSO4↓+2Br-+4H+.
故答案为:检查装置气密性;通入N2气一段时间然后关闭;
(2)由于空气中的二氧化碳对实验会产生影响,则实验前应该通入N2气一段时间,以便排尽装置中的空气,
故答案为:排尽装置中的空气,防止空气中的CO2对实验产生影响;
(3)圆底烧瓶中亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑,
故答案为:Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
(4)实验的目的是检验碳、硅非金属性的相对强弱,所以试管A应该为产生二氧化碳装置,盛放的试剂为饱和碳酸钠溶液;试管B是除去二氧化硫的装置,避免二氧化硫影响性质检验,可以用酸性高锰酸钾溶液;试管C证明碳酸酸性大于硅酸,应该盛放硅酸钠溶液,
故答案为:饱和NaHCO3溶液、酸性KMnO4溶液、Na2SiO3溶液;
(5)二氧化碳与Na2SiO3溶液反应生成硅酸,证明了碳酸酸性比硅酸强,说明碳元素的非金属性比硅元素非金属性强,所以盛有Na2SiO3溶液的试管C中出现白色沉淀即说明碳元素的非金属性比硅元素非金属性强,
故答案为:试管C中出现白色胶状沉淀;
2.(1)验证SO2的氧化性、还原性和酸性氧化物的通性,需要选用第一排试管中试剂,所以操作方法为:打开a,关闭b,
故答案为:打开a,关闭b;
(2)二氧化硫能够与氢氧化钠溶液发生中和反应,滴有酚酞的氢氧化钠溶液与二氧化硫反应后溶液变成无色,从而证明二氧化硫具有酸性氧化物的通性;
最后的试管中盛放的氢氧化钠溶液是用于吸收多余的二氧化硫,否则污染空气,
故答案为:验证SO2具有酸性氧化物的通性;除去剩余SO2气体,防止污染空气;
(3)硫化氢与二氧化硫能够发生氧化还原反应生成S单质,盛有H2S溶液的试管中出现浅黄色浑浊现象,说明生成了S单质,二氧化硫中硫元素的化合价从+4价变为0价,表现了氧化性,反应的化学方程式为:SO2+2H2S=3S↓+2H2O,
故答案为:H2S溶液中有浅黄色浑浊出现;SO2+2H2S=3S↓+2H2O;
(4)BaCl2溶液中无明显现象,将其分成两份,一份滴加氯水溶液,溴水中有氯气分子,溴水具有氧化性,能把二氧化硫氧化成+6价的硫酸根离子,硫酸根离子和钡离子反应生成BaSO4白色沉淀,反应的方程式为:SO2+Br2+Ba2++2H2O=BaSO4↓+2Br-+4H+;另一份中滴加氨水,二氧化硫和水生成亚硫酸,亚硫酸和氨水反应生成亚硫酸铵,亚硫酸铵电离出氨根离子和亚硫酸根离子,亚硫酸根离子和钡离子反应生成BaSO3,
故答案为:
| 滴加的溶液 | 溴水 | 氨水 |
| 沉淀的化学式 | BaSO4 | BaSO3 |
点评:本题探究了碳、硅非金属性的相对强弱及二氧化硫的化学性质,题目难度中等,试题题量较大、综合性较强,覆盖的知识点较前面,明确反应原理是解答的关键,注意基础知识的掌握.

练习册系列答案
相关题目
有M、X、Y、Z、W五种原子序数依次增大的短周期元素,其中其中X、Y、Z、W同周期,M、Z同主族; X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A、X、M两种元素形成的化合物只能存在离子键 |
| B、元素Y、Z、W形成的单质中,每1mol它们的单质均含有NA个分子 |
| C、由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 |
| D、元素W和M的某些单质可作为水处理中的消毒剂 |
已知分解1mol H2O2放出热量98kJ.在含少量I-的溶液中,H2O2分解的机理为H2O2+I--→H2O+IO- 慢 H2O2+IO--→H2O+O2+I- 快下列有关该反应的说法正确的是( )
| A、反应速率与I-浓度有关 |
| B、IO-是该反应的催化剂 |
| C、当反应放出98 kJ的热量时会生成1 mol O2 |
| D、v(H2O2)=v(H2O)=v(O2) |
一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol?L-1.下列有关判断不正确的是( )
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |

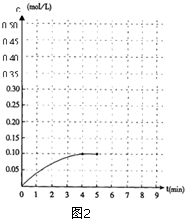 内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2:
内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2: