题目内容
将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2?2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率? .
考点:化学平衡的计算
专题:化学平衡专题
分析:令参加氮气的转化率为xmol,根据平衡混合气体对氢气的相对密度为4.19,结合相对密度之比等于相对分子质量之比,依据三段式法求平衡时的平均相对分子质量来计算.
解答:
解:根据分析M始=
=7.2g?mol-1 M平=2×4.19=8.38g?mol-1 n始=2+8=10mol,
∵反应前后气体的质量不变,∴n始M始=n平M平
n平=
=
=8.6mol,
设N2的转化率为x
由反应 N2+3H2 2NH3
2NH3
n始 2mol 8mol 0
n变 2x mol 6x mol 4x mol
n平(2-2x)mol (8-6x)mol 4x mol
∴(2-2x)+(8-6x)+4x=8.6
x=0.35=35%
故答案为:35%.
| 2×28+8×2 |
| 2+8 |
∵反应前后气体的质量不变,∴n始M始=n平M平
n平=
| n始M始 |
| M平 |
| 10×7.2 |
| 8.38 |
设N2的转化率为x
由反应 N2+3H2
 2NH3
2NH3n始 2mol 8mol 0
n变 2x mol 6x mol 4x mol
n平(2-2x)mol (8-6x)mol 4x mol
∴(2-2x)+(8-6x)+4x=8.6
x=0.35=35%
故答案为:35%.
点评:本题考查化学平衡的有关计算,难度不大,注意相对密度之比等于相对分子质量之比,与三段式解题法的运用.

练习册系列答案
 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案
相关题目
已知t℃时,盐M(不含结晶水,式量为126)的溶解度为Sg.在一定量的M的水溶液中加入agM后,恰好形成t℃时的饱和溶液,则需加入的M?7H2O的质量为( )
| A、2ag | ||
| B、(2+S/100)ag | ||
C、
| ||
D、(1+
|
已知分解1mol H2O2放出热量98kJ.在含少量I-的溶液中,H2O2分解的机理为H2O2+I--→H2O+IO- 慢 H2O2+IO--→H2O+O2+I- 快下列有关该反应的说法正确的是( )
| A、反应速率与I-浓度有关 |
| B、IO-是该反应的催化剂 |
| C、当反应放出98 kJ的热量时会生成1 mol O2 |
| D、v(H2O2)=v(H2O)=v(O2) |
一定温度下,在固定容积、体积为2L的密闭容器中充入1molN2和3molH2发生反应,当反应进行到10s末时达到平衡,此时容器中c(NH3)=0.15mol?L-1.下列有关判断不正确的是( )
| A、反应达平衡时N2的转化率为7.5% |
| B、反应进行到10s末时,H2的平均反应速率是0.0225mol?(L?s)-1 |
| C、该反应达到平衡时的标志是容器中气体压强不再改变 |
| D、该反应达到平衡时的标志是容器中气体密度不再改变 |
把6mol A气体和5mol B气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g)经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L?min),下列说法中正确的是( )
| A、A的平均反应速率为0.15mol/(L?min) |
| B、恒温达到平衡时容器内压强为开始时的85% |
| C、B的转化率为10% |
| D、平衡时A的浓度为0.8mol/L |

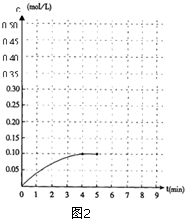 内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2:
内加入0.2mol的N2和0.6mol 的H2,在一定条件下发生如下反应:N2 (g)+3H2(g)?2NH3(g)△H<0.反应中NH3的物质的量浓度的变化的情况如图2: