题目内容
12.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2•6H2O,设计了如图流程: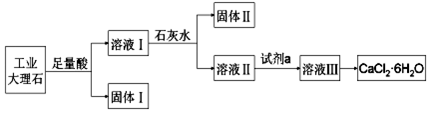
下列说法不正确的是( )
| A. | 固体Ⅰ中含有SiO2 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为[Al(OH)4]- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
分析 工业大理石含有少量SiO2、Al2O3、Fe2O3等杂质,制取CaCl2•6H2O,由流程可知,Al2O3、Fe2O3、大理石均与盐酸反应,则固体I为SiO2,溶液I中含铝离子、铁离子,均与石灰水反应生成Al(OH)3、Fe(OH)3,过滤后溶液Ⅱ中加试剂a为盐酸,中和碱且抑制水解,溶液Ⅲ蒸发浓缩、冷却结晶得到CaCl2•6H2O,以此来解答.
解答 解:工业大理石含有少量SiO2、Al2O3、Fe2O3等杂质,制取CaCl2•6H2O,由流程可知,Al2O3、Fe2O3、大理石均与盐酸反应,则固体I为SiO2,溶液I中含铝离子、铁离子,均与石灰水反应生成Al(OH)3、Fe(OH)3,过滤后溶液Ⅱ中加试剂a为盐酸,中和碱且抑制水解,溶液Ⅲ蒸发浓缩、冷却结晶得到CaCl2•6H2O,
A.由上述分析可知,固体Ⅰ中含有SiO2,故A正确;
B.氢氧化铝具有两性,使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为[Al(OH)4]-,故B正确;
C.试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O的过程中,须控制条件防止其分解,应冷却结晶分离,故C正确;
D.若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶不能得到纯净CaCl2•6H2O,混有杂质铵盐,故D错误;
故选D.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、发生的反应、实验流程为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
相关题目
17. 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
 某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )
某班学生用0.1mol•L-1盐酸和0.1mol•L-1NaOH溶液反应测定酸碱滴定曲线,甲、乙、丙三组同学锥形瓶中的溶液所取体积均为20.00mL,且所用的试剂完全相同,根据实验所得的数据绘制的曲线分别如图中a、b、c所示,下列说法错误的是( )| A. | 乙组同学操作上的不足是在滴定终点附近测试和记录pH的间隔太大 | |
| B. | 甲组同学滴定时选用的滴定管为酸式滴定管 | |
| C. | 乙和丙两组同学的操作均存在不足或失误 | |
| D. | 丙组同学可能是用待测液润洗了锥形瓶 |
3.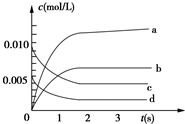 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
(1)800℃,反应达到平衡时,NO的物质的量浓度是0.0035mol/L;
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3 mol/(L•s).
(3)能说明该反应已达到平衡状态的是b、c.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(2)如图中表示NO2的变化的曲线是b.用O2表示从0~2s内该反应的平均速率v=1.5×10-3 mol/(L•s).
(3)能说明该反应已达到平衡状态的是b、c.
a.v(NO2)=2v(O2)b.容器内压强保持不变
c.v逆(NO)=2v正(O2)d.容器内密度保持不变
(4)能使该反应的反应速率增大的是bcd.
a.及时分离出NO2气体b.适当升高温度
c.增大O2的浓度d.选择高效催化剂.
20.己知某溶液中含有C1-,Br-和CrO42-,浓度均为0.010mo1•L-1,向该溶液中逐滴加入0.010mol•L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.
Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.
| A. | C1-、Br-、CrO42- | B. | CrO42-、Br-、C1- | C. | Br-、C1-、CrO42- | D. | Br-、CrO42-、C1- |
7.下列说法错误的是( )
| A. | 油脂在碱性条件下水解得到高级脂肪酸和甘油 | |
| B. | 乙酸和乙酸乙酯中都存在碳氧双键 | |
| C. | 酯化反应和酯的水解反应互为可逆反应 | |
| D. | 乙酸乙酯和油脂完全燃烧都只生成CO2和H2O |
17.含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,则此溶液中SO42-的物质的量浓度为( )
| A. | 0.9 mol/L | B. | 1.8 mol/L | C. | 0.7mol/L | D. | 0.5mol/L |
4.下列表述正确的是( )
| A. | 硫酸铝的电离方程式:Al2(SO4)3=2Al3++3SO42- | |
| B. | 小苏打的电离方程式:NaHCO3=Na++H++CO32- | |
| C. | Mg(OH)2难溶于水,所以Mg(OH)2不是电解质,而是非电解质 | |
| D. | K2CO3溶液能导电,所以K2CO3溶液是电解质 |