题目内容
17.含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,则此溶液中SO42-的物质的量浓度为( )| A. | 0.9 mol/L | B. | 1.8 mol/L | C. | 0.7mol/L | D. | 0.5mol/L |
分析 混合溶液中存在电荷守恒,即3c(Al3+)+2c(Mg2+)=2c(SO42-),溶液中H+、OH-离子浓度较小,可忽略不计,以此解答该题.
解答 解:含有MgSO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,Mg2+的物质的量浓度为0.3mol/L,
溶液中存在电荷守恒,即3c(Al3+)+2c(Mg2+)=2c(SO42-),
则c(SO42-)=$\frac{2×0.3mol/L+3×0.4mol/L}{2}$=0.9mol/L,
故选A.
点评 本题考查物质的量浓度的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握相关计算公式的运用,从电荷守恒的角度解答该题,难度不大.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
2.在浓度均为3mol/L的盐酸和硫酸各100mL溶液中,分别加入等质量的铁粉,充分反应后生成气体质量之比为3:4.则加入铁粉的质量是( )
| A. | 1.8 g | B. | 11.2 g | C. | 5.6 g | D. | 8.4 g |
5.T℃时,将A和B各0.32mol充入恒容密闭容器中,发生反应:A(g)+B(g)?2C(g)△H=-a kJ•mol-1(a>0),反应过程中测定的数据如表,下列说法正确的是( )
| t/min | 0 | 2 | 4 | 7 | 9 |
| n(B)/mol | 0.32 | 0.24 | 0.22 | 0.20 | 0.20 |
| A. | 若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ | |
| B. | 恒温,如果压缩容器体积,B的浓度和体积分数均不变 | |
| C. | 若起始时向容器中充入 0.64 mol A 和 0.64 mol B,则达平衡时 n(C)<0.48 mol | |
| D. | 恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大 |
12.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2•6H2O,设计了如图流程:
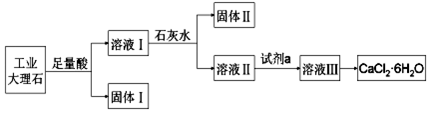
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 固体Ⅰ中含有SiO2 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为[Al(OH)4]- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
6.已知某物质的物质的量,下列物理量中一定能够计算出值的是( )
| A. | 体积 | B. | 质量 | C. | 密度 | D. | 粒子数 |
7.下列食品中属于碱性食品的是( )
| A. | 鸡肉 | B. | 大米 | C. | 柠檬 | D. | 鱼肉 |
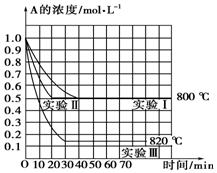 在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答:
在一恒容密闭容器中发生某化学反应2A(g)?B(g)+C(g),在三种不同条件下进行,其中实验Ⅰ、Ⅱ在800℃,实验Ⅲ在820℃,B、C的起始浓度都为0,反应物A的浓度(mol•L-1)随时间(min)的变化如图所示,请回答: