题目内容
1.(1)下列气态分子BCl3、CCl4、H2O和BeCl2中,其键角由大到小的顺序为BeCl2>BCl3>CCl4>H2O.(2)硫化氢(H2S)分子的空间构型为V形;二氧化碳(CO2)分子的空间构型为直线形;甲烷(CH4)分子的空间构型为正四面体.
分析 (1)CCl4为正四面体结构键角为109°28′,H2O分子的空间结构为V形,键角为为107°,BeCl2的空间结构为直线形,键角为180°,BCl3的空间结构为平面三角形,键角为120°,由此分析解答;
(2)根据分子中中心原子的价层电子对数判断.
解答 解:(1)CCl4为正四面体结构键角为109°28′,H2O分子的空间结构为V形,键角为为107°,BeCl2的空间结构为直线形,键角为180°,BCl3的空间结构为平面三角形,键角为120°,所以键角由大到小的顺序为BeCl2>BCl3>CCl4>H2O;
故答案为:BeCl2>BCl3>CCl4>H2O;
(2)硫化氢(H2S)中S元素的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,含有2孤电子对,所以分子的空间构型为 V形;二氧化碳(CO2)中C原子分子的价层电子对数=2+$\frac{1}{2}$×(4-2×2)=2,不含有孤电子对,空间构型为 直线形;甲烷(CH4)分子中C原子分子的价层电子对数=4+$\frac{1}{2}$×(4-4×1)=4,没有孤电子对,空间构型为正四面体;
故答案为:V形;直线形;正四面体.
点评 本题考查了分子空间构型的判断、键角等,题目难度中等,注意把握分子中原子的价层电子对数的判断方法.

练习册系列答案
 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案
相关题目
12.某同学采用工业大理石(含有少量SiO2、Al2O3、Fe2O3等杂质)制取CaCl2•6H2O,设计了如图流程:
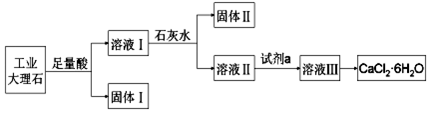
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 固体Ⅰ中含有SiO2 | |
| B. | 使用石灰水时,要控制pH,防止固体Ⅱ中Al(OH)3转化为[Al(OH)4]- | |
| C. | 试剂a选用盐酸,从溶液Ⅲ得到CaCl2•6H2O的过程中,须控制条件防止其分解 | |
| D. | 若改变实验方案,在溶液Ⅰ中直接加氨水至沉淀完全,滤去沉淀,其溶液经蒸发浓缩、冷却结晶也可得到纯净CaCl2•6H2O |
6.已知某物质的物质的量,下列物理量中一定能够计算出值的是( )
| A. | 体积 | B. | 质量 | C. | 密度 | D. | 粒子数 |
10.日本理化学研究所的科研人员合成了113号元素,该元素所在周期表的位置是( )
| A. | 第六周期,ⅣA族 | B. | 第七周期,ⅣA族 | C. | 第六周期,ⅢA族 | D. | 第七周期,ⅢA族 |
5.已知:Ksp(AgCl)=1.8×10-10;Ksp(Ag2S)=6.3×10-50.向盛0.1mol/L AgNO3溶液的试管中滴加0.1mol/L Na2S溶液至沉淀完全,再滴加足量NaCl溶液,产生的现象或生成的物质是( )
| A. | 黑色沉淀完全转化为白色沉淀 | B. | 既有氯化银也有硫化银 | ||
| C. | 只产生黑色硫化银沉淀 | D. | 只有氯化银白色沉淀 |