题目内容
16.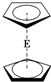 E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为
E(C5H5)2的结构如图,其中氢原子的化学环境完全相同.但早期人们却错误地认为它的结构为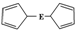 .1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )
.1H核磁共振法能够区分这两种结构.在1H核磁共振谱中,错误的结构与正确的结构1H核磁共振谱的峰分别为( )| A. | 5,5 | B. | 3,5 | C. | 5,1 | D. | 3,1 |
分析 根据分子结构与对称性确定氢原子的种类,核磁共振氢谱中有几种不同的氢原子会有几种峰值.
解答 解:制备的E(C5H5)2的正确结构如图,其中氢原子的化学环境完全相同,核磁共振氢谱中峰值为1,错误结构为: 结构中含有三种位置的氢原子,所以核磁共振氢谱中峰值为3;
结构中含有三种位置的氢原子,所以核磁共振氢谱中峰值为3;
故选D.
点评 本题考查核磁共振氢谱与有机物中氢原子的种类关系,题目难度不大,核磁共振氢谱中峰值数等于有机物中氢原子的种类数.

练习册系列答案
相关题目
7.剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染.已知部分弱酸的电离平衡常数如下表:
下列选项错误的是( )
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 ( 25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN) | |
| C. | 中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者 | |
| D. | 等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者 |
4. 常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
 常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | HA和MOH均为弱电解质 | |
| B. | 曲线a中,滴加溶液到20mL时,c(Cl-)=c(M+)=c(OH-)=c(H+) | |
| C. | 曲线b中,滴加溶液到20mL时,c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 曲线b中,滴加溶液到10mL时,c(A-)+c(OH-)=c(H+)+c(HA) |
1.将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成氯化钠、次氯酸钠、氯酸钠共存体系.下列判断正确的是( )
| A. | 与氢氧化钠反应的氯气一定为0.16 mol | |
| B. | n(Na+):n(Cl-)可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
6.下列各项所述的两个量,前者一定大于(或高于)后者的是( )
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
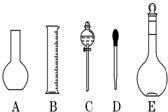 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题: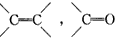 的不饱和度均为1,现有结构简式为
的不饱和度均为1,现有结构简式为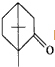 的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )
的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )