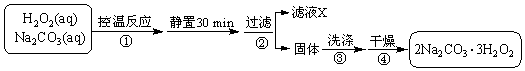
题目内容
11.电离平衡常数是衡量弱电解质电离程度的物理量.已知:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
分析 ①根据酸的电离常数进行分析判断,电离常数越大,对应盐的水解程度越小,溶液的pH越小;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
解答 解:①根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH大小为:Na2CO3>NaCN>CH3COONa,
故答案为:Na2CO3>NaCN>CH3COONa;
②向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,则反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,
故答案为:NaCN+H2O+CO2=HCN+NaHCO3.
点评 本题考查了弱电解质的电离平衡及其应用,题目难度中等,根据电离平衡常数正确判断酸性强弱为解答关键,注意掌握盐的水解原理及其影响,试题培养了学生的灵活应用能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.由菱镁矿(主要成分为MgCO3)制阻燃型氢氧化镁的工艺流程如下:
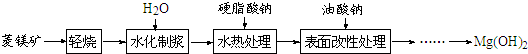
(1)从图1和图2可以得出的结论为随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加、温度升高,水化反应速率加快.

(2)水化反应MgO+H2O═Mg(OH)2能自发进行的原因是△H<0.
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等).(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
(4)已知热化学方程式:Mg(OH)2(s)═MgO(s)+H2O(g)△H=+81.5kJ•mol-1
①Mg(OH)2起阻燃作用的主要原因是Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是无烟、无毒、腐蚀性小.

(1)从图1和图2可以得出的结论为随着水化时间延长,MgO的量不断减少,Mg(OH)2的量不断增加、温度升高,水化反应速率加快.

(2)水化反应MgO+H2O═Mg(OH)2能自发进行的原因是△H<0.
(3)结合元素周期律和下表可知,金属氢氧化物受热分解的规律有金属离子半径越大,氢氧化物越难分解(或金属性越强,氢氧化物越难分解等).(写一条即可)
部分主族元素的金属氢氧化物热分解温度/℃
| LiOH | NaOH | KOH | Al(OH)3 | Mg(OH)2 | Ca(OH)2 | Ba(OH)2 |
| 924 | 不分解 | 不分解 | 140 | 258 | 390 | 700 |
①Mg(OH)2起阻燃作用的主要原因是Mg(OH)2分解时吸热,使环境温度下降;同时生成的耐高温、稳定性好的MgO覆盖在可燃物表面,阻燃效果更佳.
②与常用卤系(如四溴乙烷)和有机磷系(磷酸三苯酯)阻燃剂相比,Mg(OH)2阻燃剂的优点是无烟、无毒、腐蚀性小.
3.下列说法正确的是( )
| A. | 石油裂解可以得到氯乙烯 | |
| B. | 油脂水解可得到氨基酸和甘油 | |
| C. | 所有烷烃和蛋白质中都存在碳碳单键 | |
| D. | 淀粉和纤维素水解的最终产物都是葡萄糖 |
 如图所示A是固体金属单质,燃烧时火焰呈黄色.
如图所示A是固体金属单质,燃烧时火焰呈黄色. 实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题:
实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题: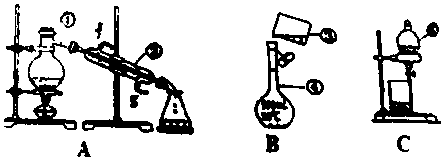
 2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.
2015年8月12日23:30左右,天津滨海新区的一处集装箱码头发生爆炸,发生爆炸的是集装箱内的易燃易爆物品氰化钠,数量为700吨左右.