题目内容
6. 实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题:
实验室用氢氧化钠固体配制1.0mol•L-1的NaOH溶液250mL,回答下列问题:(1)实验仪器:托盘天平、药匙、烧杯、玻璃棒、(量筒)、250mL容量瓶,胶头滴管.
(2)实验步骤:①计算:②称量,③溶解,④移液,⑤洗涤,⑥定容⑦摇匀.
称量所需氯化钠的质量为10.0g.
(3)下列操作使所配溶液的浓度偏大的有CD;
A.托盘天平的托盘放上纸称量NaOH
B.未洗涤溶解NaOH的烧杯
C.溶解后未冷却就立即转移到容量瓶中
D.定容时俯视刻度线
E.摇匀,静置后发现液面不到刻度线,再加水至刻度线
F.容量瓶未干燥即用来配制溶液
(4)如图是实验步骤④的示意图,图中的错误是未用玻璃棒引流;未使用250 mL容量瓶;.
分析 (1)根据配制一定物质的量浓度的溶液操作步骤,判断需要的玻璃仪器;
(2)根据配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作来解答;根据m=nM=cVM计算氢氧化钠的质量;
(3)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(4)根据容量瓶的构造及使用方法解答.
解答 解:(1)配制一定物质的量浓度的溶液步骤有:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、筒量、玻璃棒、容量瓶、胶头滴管;
故答案为:250mL容量瓶,胶头滴管;
(2)实验步骤:①计算:②称量,③溶解,④移液,⑤洗涤,⑥定容,⑦摇匀;配制1.0mol•L-1的NaOH溶液250mL,需要氢氧化钠的质量为:m(NaOH)=40g/mol×1.0mol•L-1×0.25L=10.0g,
故答案为:定容,10.0;
(3)A、NaOH固体易潮解,托盘天平的托盘放上纸称量NaOH,会导致称得氢氧化钠的质量偏小,配制溶液的浓度偏低;
B、未洗涤溶解NaOH的烧杯,会导致溶质的物质的量偏小,配制溶液的浓度偏低;
C、溶解后未冷却就立即转移到容量瓶中,冷却后溶液的体积偏小,配制溶液的浓度偏高;
D、定容时俯视刻度线,导致加入的蒸馏水体积偏小,配制的溶液浓度偏高;
E、摇匀,静置后发现液面不到刻度线,再加水至刻度线,导致加入的蒸馏水体积偏大,配制的溶液浓度偏低;
F、容量瓶未干燥即用来配制溶液,对溶液浓度无影响,因为只要定容时正确,至于水是原来就有的还是后来加入的,对浓度无影响;
故答案为:CD;
(4)容量瓶瓶颈比较细,向容量瓶中转移液体时,要用玻璃棒来引流;250mL溶液只能用250 mL容量瓶;
故答案为:未用玻璃棒引流;未使用250 mL容量瓶.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案| A. | 氨水 | B. | 氢氧化钠 | C. | 氢氧化钡 | D. | 氢氧化钙 |
| 加入物质 | HCl(aq) | FeCl3 | NaOH | CH3COONa | C2H5OH |
| 溶液的pH | 3 | 4 | 10 | 11 | 未测定 |
| 水的电离程度 | α1 | α2 | α3 | α4 | α5 |
| A. | α3>α1>α5>α4>α2 | B. | α4>α2>α5>α3>α1 | C. | α2>α4>α5>α1>α3 | D. | α1>α3>α5>α2>α4 |
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
②向NaCN溶液中通入少量的CO2,发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
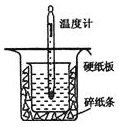 中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
中和热的测定是高中重要的定量实验.取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:(1)从如图实验装置看,其中尚缺少的一种玻璃用品是环形玻璃搅拌棒_,
(2)若改用60mL 0.25mol•L-1H2SO4和50mL 0.55mol•L-1NaOH溶液进行反应与上述实验相比,所放出的热量不相等(填“相等”、“不相等”),若实验操作均正确,则所求中和热相等填“相等”“不相等”)
(3)倒入NaOH溶液的正确操作是:C. (从下列选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(4)实验数据如表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)abc.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 氢氟酸具有酸性,可用于雕刻玻璃 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | NH3具有还原性,可用NH3与灼热CuO作用制取少量N2 |
(1)氨气可以构成燃料电池,其电池反应原理为4NH3+3O2=2N2+6H2O.NH3应通入燃料电池的负极(填“正极”或“负极”).已知电解质溶液为KOH溶液,负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(2)在0.5L恒容密闭容器中,一定量的N2与H2进行反应:N2(g)+3H2(g)?2NH3(g)△H=bkJ•mol-1,其化学平衡常数K与温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.85 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是ad(填字母序号);
a.增大压强 b.使用合适的催化剂
c.升高温度 d.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量分别为3mol、2mol、1mol时,此时刻该反应的v正(N2) 小于v逆(N2)(填“大于”“小于”或“等于”).
(3)已知:
①4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.8kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化的热化学方程式4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905.8 kJ/mol.
 如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质.
如图表示的是A→E五种物质的相互转化关系,其中A为淡黄色固体,B为单质.