题目内容
3.用2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应制取Cl2,被氧化的HCl和未被氧化的HCl的质量之比为( )| A. | 1:8 | B. | 2:5 | C. | 5:2 | D. | 5:3 |
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素被氧化,对应产物Cl2是氧化产物,化合价降低的Mn元素被还原,所在的反应物KMnO4是氧化剂,在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,以此来解答.
解答 解:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中,化合价升高的Cl元素被氧化,对应产物Cl2是氧化产物,由原子守恒可知,在反应的16HCl(浓)中,被氧化的占10mol,未被氧化的HCl为6mol,被氧化与未被氧化的HCl的物质的量比等于质量比,被氧化与未被氧化的HCl的质量之比为10:6=5:3,
故选D.
点评 本题考查氧化还原反应的计算,把握反应中元素的化合价变化及原子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
相关题目
20.亚硝酸盐参加反应时,既可作氧化剂,也可作还原剂,当它作氧化剂时,可能的产物是( )
| A. | NH4 | B. | N2 | C. | N2O5 | D. | N2O3 |
14.一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,以此二甲醚燃料电池为电源进行电解的实验装置如图所示.下列说法正确的是( )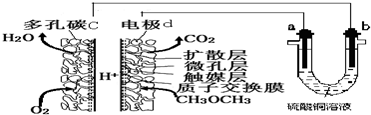

| A. | 多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 | |
| B. | 燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O═2CO2+12H+ | |
| C. | 二甲醚直接燃料电池能量密度( kW•h•kg-1)约为甲醇CH3OH)直接燃料电池能量密度的1.4倍 | |
| D. | a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
18.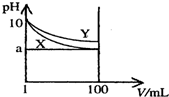 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
 常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )
常温下,pH=10的X、Y两种碱溶液各1mL,分别稀释至100mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是( )| A. | Y碱溶液稀释过程中溶液中c(H+)减小 | |
| B. | 稀释后,X溶液的碱性比Y溶液的碱性弱 | |
| C. | 分别完全中和X、Y这两种碱溶液时,消耗同浓度盐酸的体积VX>VY | |
| D. | 若8<a<10,则X、Y都是弱碱 |
8.将32g CuO热到900℃,CuO部分分解为Cu2O,最后固体质量为31.2g.则未分解的CuO与分解的CuO的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
15.溶液体积和pH都相同的一元强酸X与一元弱酸溶液Y,已知弱酸的电离度为0.5%,则X和Y溶液分别中和相同浓度的NaOH溶液时,所需Y溶液的体积是X溶液的( )
| A. | 20倍 | B. | 100倍 | C. | 200倍 | D. | 500倍 |
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.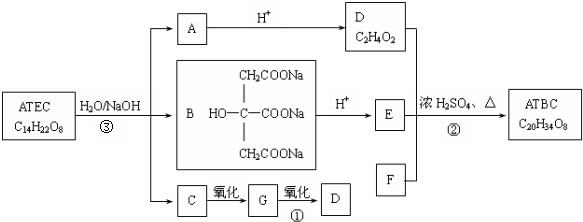
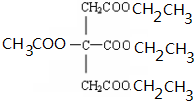 +NaOH$\stackrel{△}{→}$CH3COONa+
+NaOH$\stackrel{△}{→}$CH3COONa+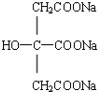 +3CH3CH2OH+3H2O.
+3CH3CH2OH+3H2O.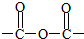 ,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.
,E分子在浓硫酸、加热条件下可生成分子甲,其分子式为C6H6O6,则符合上述条件甲分子有2种.
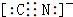 .
.