题目内容
14.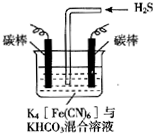 电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )
电解原理在消除环境污染领域有广泛的应用.工业上常采用如图所示电解装置,利用铁的化合物中[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身转化为[Fe(CN)6]4-.通电电解,然后通入H2S加以处理,下列说法不正确的是( )| A. | 电解时阳极反应式为[Fe(CN)6]4--e-=[Fe(CN)6]3- | |
| B. | 电解过程中阴极区溶液的pH变大 | |
| C. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| D. | 通入H2S时发生反应的离子方程式为:2[Fe(CN)6]3-+2CO32-+H2S=2[Fe(CN)6]4-+2HCO3-+S↓ |
分析 A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高;
B、阴极发生还原反应,电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电;
C、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中不需要不断补充K4[Fe(CN)6]与KHCO3;
D、通入H2S时发生反应的离子方程式为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S.
解答 解:A、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,所以反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-,故A正确;
B、电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电,所以电极反应式为2HCO3-+2 e-═H2↑+2CO32-,pH变大,故B正确;
C、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中需要不断补充K4[Fe(CN)6]与KHCO3,故C错误;
D、通入H2S时发生反应的离子方程式为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,故D正确;
故选C.
点评 本题主要考查了利用电解原理来判断电极方程式、转移电子数等,难度不大,抓住电解的原理分析阴阳极的反应是解题的根本.

练习册系列答案
相关题目
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O=ZnO+Mn(OH)2,下列说法中,错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
5.下列有机物名称正确的是( )
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
①2-乙基戊烷?②1,2-二氯丁烷?③2,2-二甲基-4-己醇 ④3,4-二甲基戊烷 ⑤二溴乙烷 ⑥1-甲基丙醇
⑦2-甲基-3-戊炔 ⑧2-甲基-1,3-丁二烯.
| A. | ①⑤⑥ | B. | ②③④ | C. | ②⑧ | D. | ③⑥⑦ |
2.对乙烯基苯甲酸在医药中间体合成中有着广泛的用途,可用化合物M反应合成:
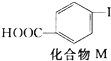 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$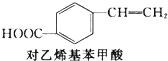 +HI
+HI
下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$ +HI
+HI下列关于化合物M和对乙烯基苯甲酸的说法正确的是( )
| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
9.金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技 材料,被誉为“未来金属”.以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如图1
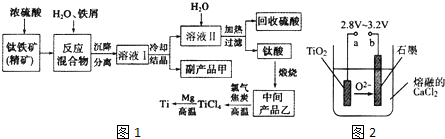
请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于10时,Mg(OH)2开始沉淀.若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为TiO2++2H2O=TiO(OH)2↓.
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.

请回答下列问题:
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C$\frac{\underline{\;高温\;}}{\;}$2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为FeTiO3;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为FeTiO3+2H2SO4$\frac{\underline{\;高温\;}}{\;}$TiOSO4+FeSO4+2H2O.
(2)上述生产流程中加入铁屑的目的是防止Fe2+被氧化为Fe3+.此时溶液中含有 Fe2+、TiO2+和少量Mg2+等阳离子.常温下,其对应氢氧化物的Ksp如表所示.
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO.Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气.除去所得金属钛中少量的金属镁可用的试剂是稀盐酸.
(4)在800~1000℃时电解TiO2也可制得海绵钛,装置如图2所示.图中b是电源的正极,阴极的电极反应式为TiO2 +4e-=Ti+2O2-.
6.根据下列物质变化,所得能量变化关系正确的是( )
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 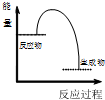 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
3.某溶液中可能含有K+、Ba2+、NH4+、S2-、I-、SO42-,分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | K+ | B. | NH4+ | C. | SO42- | D. | S2- |
4.下列有关说法正确的是( )
| A. | 分离Fe2O3、Al2O3操作依次为溶解、过滤、灼烧 | |
| B. | 粗盐可通过溶解、过滤、蒸发、结晶的方法提纯 | |
| C. | 配制氯化铁溶液,是将FeCl3溶于蒸馏水,再加入一定量的铁粉 | |
| D. | 取用金属钠或钾时,没用完的钠或钾要放回原瓶 |
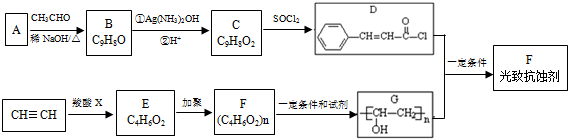
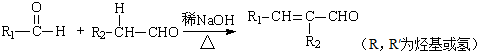
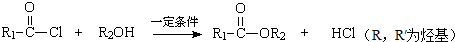
 .
. .
. .
.