题目内容
15.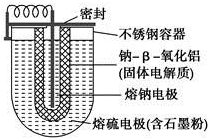 如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为
如图所示,NaS电池是当前开发的一种高性能可充电电池,它所贮存的能量为常用铅蓄电池的5倍(按相同质量计),电池反应为2Na(l)+S8(l)$?_{放电}^{充电}$Na2Sn.下列说法不正确的是( )
| A. | 外室熔融硫中添加石墨粉主要是为了增强导电性 | |
| B. | 放电时Na+向正极移动 | |
| C. | 充电时阳极反应式为8S-16e-═nS8 | |
| D. | 充电时钠极与外接电源的正极相连 |
分析 A、由于硫是绝缘体,故在外室填充石墨粉以保证良好的导电性;
B、在原电池中,阳离子向正极移动,阴离子向负极移动;
C、充电时阳极发生氧化反应;
D、充电时钠极发生还原反应,应与外接电源的负极相连.
解答 解:A、由于硫是绝缘体,故在外室填充石墨粉以保证良好的导电性,A正确;
B、在原电池中,阳离子向正极移动,阴离子向负极移动,形成闭合回路,B正确;
C、充电时阳极发生氧化反应,C正确;
D、充电时钠极发生还原反应,应与外接电源的负极相连,D错.
故选D.
点评 本题考查原电池原理,明确电池反应中元素的化合价变化及原电池的工作原理即可解答,注意与氧化还原反应的结合,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
13.戊醇的分子式为C5H120,若由戊烯与水发生加成反应生成戊醇,则生成的戊醇的结构最多有(不考虑立体异构 )( )
| A. | 5种 | B. | 7种 | C. | 8种 | D. | 9种 |
6.将1.5mL0.1mol•L-1Na2SO4溶液和1.0mL0.1mol•L-1BaCl2溶液混合后得到浊液a,过滤得到滤液b和白色沉淀c.下列分析不正确的是( )
| A. | 浊液a中存在沉淀溶解平衡:BaSO4(s)?Ba2+(aq)+SO42-(aq) | |
| B. | 若向滤液b中滴加0.01mol•L-1Na2SO4溶液,无明显现象 | |
| C. | 若向滤液b中滴加0.01mol•L-1BaCl2溶液,会出现白色沉淀 | |
| D. | 若向滤液b中滴加0.01mol•L-1AgNO3溶液,无明显现象 |
3.室温下,测得Ca(ClO)2溶液中c(ClO-)=0.1mol•L-1,下列判断中错误的是( )
| A. | 加水稀释后,溶液中$\frac{c(O{H}^{-})}{c(Cl{O}^{-})}$增大 | |
| B. | 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+) | |
| C. | 溶液中2c(Ca2+)+c(H+)=c(ClO-)+c(OH-) | |
| D. | 若溶液的pH=l2,则c(ClO-)的水解百分率约为9.1% |
10.将0.1mol N2和0.3mol H2置于密闭容器中发生反应N2+3H2?2NH3下列关于该反应的说法中正确的是( )
| A. | 反应物所具有的总能量等于生成物所具有的总能量 | |
| B. | 最终可生成0.2 mol NH3 | |
| C. | 反应达平衡后,使用催化剂,不能使平衡向右移动 | |
| D. | 当n(N2):n(H2)=1:3时,一定达化学平衡 |
20.两种气态烃组成的混合气体0.1mol,完全燃烧得0.18mol CO2和3.6g H2O,下列关于该混合气体的说法正确的是( )
| A. | 一定有乙烯 | B. | 一定没有乙烯 | C. | 一定有甲烷 | D. | 一定有乙烷 |
7.下列贮存化学试剂的方法正确的是( )
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 溴水存放在带玻璃塞的无色试剂瓶中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
4.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O=ZnO+Mn(OH)2,下列说法中,错误的是( )
| A. | 电池工作时,锌失去电子 | |
| B. | 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- | |
| C. | 电池工作时,电子由正极通过外电路流向负极 | |
| D. | 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |