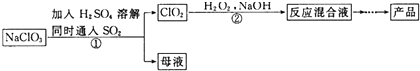
题目内容
6.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:| Q | R | ||
| T | W |
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)原子序数比R多1的元素M的一种氢化物能分解为M的另一种氢化物,此分解反应的化学方程式是2H2O2═2H2O+O2↑.
(4)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是NaNO2.
分析 T所处的周期序数与主族序数相等,则T为第三周期第ⅢA族元素Al,结合元素在短周期中的位置可知,Q为C,R为N,W为S,
(1)非金属性越强,得电子能力越强,利用最高价含氧酸的酸性可知非金属性;
(2)S与浓硫酸反应生成二氧化硫和水;
(3)原子序数比R多1的元素M为O,过氧化氢分解生成水和氧气;
(4)R有多种氧化物,其中甲的相对分子质量最小,则甲为NO,2L的甲气体与0.5L的氧气相混合含等量的NO、NO2,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,恰好生成亚硝酸钠.
解答 解:T所处的周期序数与主族序数相等,则T为第三周期第ⅢA族元素Al,结合元素在短周期中的位置可知,Q为C,R为N,W为S,
(1)元素的非金属性为(原子的得电子能力):Q<W,证明该结论的一个化学方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O,
故答案为:<;H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O,
故答案为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O;
(3)原子序数比R多1的元素M为O,过氧化氢分解生成水和氧气,分解反应为2H2O2═2H2O+O2↑,故答案为:2H2O2═2H2O+O2↑;
(4)R有多种氧化物,其中甲的相对分子质量最小,则甲为NO,2L的甲气体与0.5L的氧气相混合含等量的NO、NO2,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,由氧化还原反应的归中规律可知,生成的R的含氧酸盐的化学式是NaNO2,故答案为:NaNO2.
点评 本题考查位置、结构与性质的应用,为高频考点,把握元素的位置、性质、元素化合物为解答的关键,侧重分析与应用能力的考查,注意元素化合物及氧化还原反应的应用,题目难度不大.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案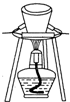
| A. | 用湿润的pH试纸测定溶液的pH | |
| B. | 用如图所示装置灼烧碱式碳酸铜[Cu2(OH)2CO3]制取氧化铜 | |
| C. | 用铜丝蘸取草木灰在酒精灯火焰灼烧检验钾元素 | |
| D. | 称取0.4g NaOH,放入100mL容量瓶中,加入蒸馏水溶解,用胶头滴管定容至刻度线,振荡摇匀,配制100mL 0.10mol/L NaOH溶液 |
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有 乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液, 加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明HCOOH结构中含有醛 基 | 将1mL 1mol/L HCOOH溶液加入装有银氨溶液 的试管中并水浴加热,观察有无银镜产生 |
| C | 除去甲烷中的乙烯 | 将混合气通入KMnO4溶液中洗气 |
| D | 制取乙烯气体 | 将无水乙醇和浓硫酸混合加热到140℃ |
| A. | A | B. | B | C. | C | D. | D |
| A. | CO2是氧化产物 | |
| B. | H2C2O4在反应中被氧化 | |
| C. | 1mol KClO3参加反应,转移的电子为1mol | |
| D. | H2C2O4的氧化性强于ClO2的氧化性 |
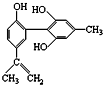 的说法正确的是( )
的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
| A. | H2O的摩尔质量为18g | |
| B. | 3.01×1023个SO2分子的质量为32g | |
| C. | 标准状况下,1 mol任何物质体积均为22.4L | |
| D. | 将0.1mol NH3溶于1L水,配成溶液中溶质的物质的量浓度为0.1mol/L |
| A. | 乙烷与氯气混合 | B. | 乙烯与氯化氢混合 | ||
| C. | 乙烯与氯气混合 | D. | 乙炔与氯气混合 |