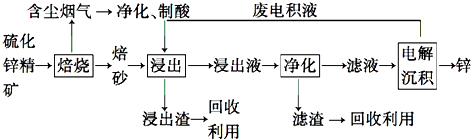
题目内容
17.下列有关实验原理或操作正确的是( )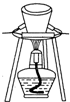
| A. | 用湿润的pH试纸测定溶液的pH | |
| B. | 用如图所示装置灼烧碱式碳酸铜[Cu2(OH)2CO3]制取氧化铜 | |
| C. | 用铜丝蘸取草木灰在酒精灯火焰灼烧检验钾元素 | |
| D. | 称取0.4g NaOH,放入100mL容量瓶中,加入蒸馏水溶解,用胶头滴管定容至刻度线,振荡摇匀,配制100mL 0.10mol/L NaOH溶液 |
分析 A.湿润的pH试纸导致溶液浓度降低,可能影响溶液的pH值;
B.灼烧固体药品用坩埚;
C.Cu的焰色反应呈绿色;
D.容量瓶只能配制一定物质的量浓度溶液,不能溶解或稀释药品.
解答 解:A.湿润的pH试纸导致溶液浓度降低,如果是酸或碱,则影响溶液的pH值,如果是强酸强碱盐溶液,则不影响溶液的pH测定,故A错误;
B.灼烧固体药品用坩埚,所以灼烧碱式碳酸铜固体应该用坩埚,故B正确;
C.Cu的焰色反应呈绿色,影响K元素检验,应该用Fe或Pt丝,故C错误;
D.容量瓶只能配制一定物质的量浓度溶液,不能溶解或稀释药品,应该先将称量的NaOH在烧杯中溶解,冷却至室温后,再将溶液转移到容量瓶中配制一定物质的量浓度溶液,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生实验操作、实验分析判断、实验评价能力,涉及溶液配制、pH值测定、仪器的选取等知识点,明确实验原理、实验基本操作、物质性质是解本题关键,易错选项是A.

练习册系列答案
相关题目
7.某有机物R的结构简式如图所示.下列关于R的说法不正确的是( )
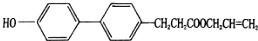

| A. | 能发生加成、加聚、水解和氧化反应 | |
| B. | 分子式为C18H20O3 | |
| C. | 该化合物最多有12个碳原子共平面 | |
| D. | 一定条件下1molR最多可以消耗2molNaoH |
5.把Mmol H2和Nmol C2H4混合,在一定条件下使它们一部分发生反应生成Wmol C2H6,将反应后所得的混合气体完全燃烧,消耗氧气的物质的量为( )
| A. | (M+3N)mol | B. | ($\frac{M}{2}$+3N)mol | C. | ($\frac{M}{2}$+3N+$\frac{7}{2}$W)mol | D. | ($\frac{M}{2}$+3N-$\frac{7}{2}$W)mol |
12.下列有关物质的分类或归类正确的是( )
①混合物:水玻璃、水银
②化合物:氯化钙、烧碱、HD
③电解质:冰醋酸、硫酸钡
④同素异形体:H2O H2O2
⑤同位素:12C、13C、14C
⑥同分异构体:
①混合物:水玻璃、水银
②化合物:氯化钙、烧碱、HD
③电解质:冰醋酸、硫酸钡
④同素异形体:H2O H2O2
⑤同位素:12C、13C、14C
⑥同分异构体:

| A. | ①③④ | B. | ③⑤⑥ | C. | ①②③ | D. | ②⑥ |
2.下列化学用语正确的是( )
| A. | -OH的电子式: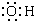 | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧化铜电离方程式:Cu(OH)2═Cu2++2OH- | |
| D. | 乙酸的分子式:C2H4O2 |
9.已知:2H2(g)+O2(g)═2H2O(g)1molH2完全燃烧放出热量为241.8KJ有关键能数据如表:
则H-H键键能为( )
| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 872KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
6.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)元素的非金属性为(原子的得电子能力):Q<W(填“>”或“<”),证明该结论的一个化学方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O.
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)原子序数比R多1的元素M的一种氢化物能分解为M的另一种氢化物,此分解反应的化学方程式是2H2O2═2H2O+O2↑.
(4)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是NaNO2.
| Q | R | ||
| T | W |
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)原子序数比R多1的元素M的一种氢化物能分解为M的另一种氢化物,此分解反应的化学方程式是2H2O2═2H2O+O2↑.
(4)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是NaNO2.
7.下列说法中正确的是( )
| A. | 氢元素有三种同位素,则氢气分子有三种 | |
| B. | 稀有气体元素原子最外层都达到8电子稳定结构 | |
| C. | 第IA、ⅡA族元素的阳离子与同周期稀有气体元素原子具有相同的核外电子排布 | |
| D. | 将盛有NH4HCO3粉末的小烧杯放人盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固,该反应中,热能转化为产物内部的能量 |