题目内容
11.有关该物质 的说法正确的是( )
的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
分析 该有机物含有酚羟基,可与溴水发生取代反应,可与高锰酸钾发生氧化反应,含有C=C官能团,可发生加成、氧化反应,结合苯环、乙烯的结构特征判断有机物的空间结构特点.
解答 解;A.含酚-OH,遇FeCl3溶液显紫色,但含2个苯环,与苯酚不属于同系物,故A错误;
B.两个苯环之间由单键相连,可以旋转,与双键碳相连的苯环也可以旋转,所以所有碳原子不一定都在同一平面上,故B错误;
C.含有酚羟基,可被酸性高锰酸钾氧化,不能证明含有碳碳双键,故C错误;
D.酚羟基的邻位可被取代、碳碳双键可与溴水发生加成反应,则1mol有机物可与4mol溴发生加成反应,苯环和碳碳双键可与氢气发生加成反应,1mol有机物可与7mol氢气发生加成反应,故D正确.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物中官能团与性质的关系,熟悉烯烃、苯酚的性质即可解答,题目难度不大.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
1.根据化学反应3NO2+H2O→2HNO3+X,推断X的化学式为( )
| A. | NO | B. | N2 | C. | N2O3 | D. | N2O5 |
2.下列化学用语正确的是( )
| A. | -OH的电子式: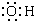 | |
| B. | 硫离子结构示意图: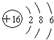 | |
| C. | 氢氧化铜电离方程式:Cu(OH)2═Cu2++2OH- | |
| D. | 乙酸的分子式:C2H4O2 |
6.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)元素的非金属性为(原子的得电子能力):Q<W(填“>”或“<”),证明该结论的一个化学方程式为H2SO4+Na2CO3=Na2SO4+CO2↑+H2O.
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)原子序数比R多1的元素M的一种氢化物能分解为M的另一种氢化物,此分解反应的化学方程式是2H2O2═2H2O+O2↑.
(4)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是NaNO2.
| Q | R | ||
| T | W |
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)原子序数比R多1的元素M的一种氢化物能分解为M的另一种氢化物,此分解反应的化学方程式是2H2O2═2H2O+O2↑.
(4)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是NaNO2.
16.经初步检测蛇纹石矿由MgO、Fe2O3、Al2O3、SiO2等组成.分析如图1:
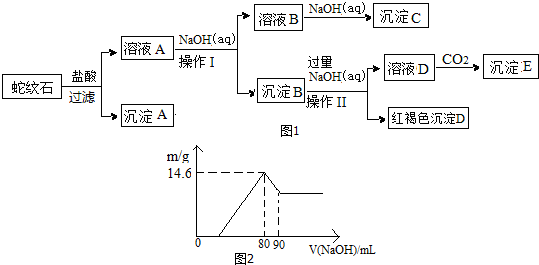
请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
A.1~3 B.3~5 C.5~7 D.7~8
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.

请回答下列问题:
(1)蛇纹石与盐酸充分反应后再过滤即可得溶液A.在过滤中用到的玻璃仪器有烧杯、玻璃棒、漏斗.
(2)沉淀B的组成是Al(OH)3、Fe(OH)3,向溶液A中逐滴加入NaOH溶液,以控制溶液pH在C的范围内可得到符合图1关系的沉淀B.(填写下列正确选项前的字母.有关氢氧化物沉淀的pH见下表,且pH达到7.8时,氢氧化铝开始溶解.)
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.9 | 3.3 | 9.4 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
(3)写出向溶液D中通入过量CO2反应的离子方程式:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)向溶液A中逐滴加入5mol•mol-1NaOH溶液,经过操作I和操作II得到的沉淀质量与V[NaOH(aq)]有图2所示的数据关系.经分析蛇纹石中Fe2O3与Al2O3的物质的量之比为2:1.
20.下列化学反应中,反应物总能量高于生成物总能量的是( )
| A. | 铝片和稀盐酸反应 | B. | 氢氧化钡晶体和氯化铵反应 | ||
| C. | 灼热的碳与CO2反应 | D. | 甲烷在氧气中燃烧 |
19.只用一种试剂就能区别乙醇、乙酸和葡萄糖三种溶液,该试剂是( )
| A. | 金属钠 | B. | 石蕊溶液 | ||
| C. | 新制的氢氧化铜悬浊液 | D. | NaHCO3溶液 |
