题目内容
18.亚氯酸钠(NaClO2)是一种高效氧化剂和漂白剂,主要用于棉纺、纸浆漂白和鱼药的制造.制备亚氯酸钠的工艺流程如下: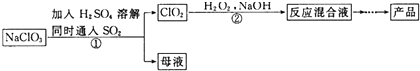
(1)要加快步骤①的反应速率,可采取的措施为升高温度或增大硫酸的浓度.(写一种即可)
(2)步骤①的离子方程式为2ClO3-+SO2=2ClO2+SO42-,每生成标准状况下22.4L的ClO2,转移电子数为NA.
(3)步骤②中H2O2的作用是还原剂;从“反应混合液”到“产品”的过程中先需蒸发溶剂,写出蒸发所需的硅酸盐仪器的名称酒精灯,蒸发皿,玻璃棒.
(4)NaClO2产品中通常混有少量NaCl.取样品wg,测得Na的物质的量为nmol,则该样品中NaClO2的物质的量为$\frac{w-58.5n}{32}$mol.
分析 NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,然后与过氧化氢在碱性条件下反应生成NaClO2,将溶液蒸发浓缩、冷却结晶、过滤可得到NaClO3,
(1)根据影响反应速率的因素采取合适的措施;
(2)反应①为NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,根据元素守恒和电荷守恒书写离子方程式,根据方程式可计算出电子转移数目;
(3)步骤②ClO2与过氧化氢在碱性条件下反应生成NaClO2,根据化合价的变化可知,双氧水将ClO2还原成NaClO2;蒸发操作通常要用到酒精灯,蒸发皿,玻璃棒等;
(4)根据NaClO2和NaCl的总质量及钠的元素的总物质的量列方程组可求得NaClO2的物质的量;
解答 解:(1)根据影响反应速率的因素可知,要加快步骤①的反应速率可以升高温度或增大硫酸的浓度等,
故答案为:升高温度或增大硫酸的浓度;
(2)NaClO3在酸性条件下与二氧化硫发生氧化还原反应生成ClO2,方程式为2ClO3-+SO2=2ClO2+SO42-,每生成22.4L ClO2,即1mol,反应中Cl元素化合价由+价降低到+4价,则转移1mol电子,
故答案为:2ClO3-+SO2=2ClO2+SO42-;NA;
(3)NaClO2与过氧化氢在碱性条件下反应生成NaClO2,方程式为H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2,根据化合价的变化可知,双氧水的作用是还原剂,蒸发操作通常要用到酒精灯,蒸发皿,玻璃棒等,
故答案为:还原剂;酒精灯,蒸发皿,玻璃棒;
(3)从“亚氯酸钠溶液”到“粗产品”需经过的操作依次是蒸发(浓缩)、(冷却)结晶、过滤,
故答案为:蒸发(浓缩);(冷却)结晶;过滤;
(4)设NaClO2的物质的量为xmol,NaCl的物质的量为ymol,根据题意有$\left\{\begin{array}{l}{x+y=n}\\{90.5x+58.5y=w}\end{array}\right.$,解得x=$\frac{w-58.5n}{32}$,即NaClO2的物质的量为$\frac{w-58.5n}{32}$,
故答案为:$\frac{w-58.5n}{32}$.
点评 本题考查物质的制备实验的工业设计,题目难度中等,本题注意把握物质的性质,从质量守恒的角度以及氧化还原反应的特点判断生成物,为解答该题的关键,也是易错点.

| 化学键 | H-O | O=O |
| 键能/KJ?mol-1 | 463.4 | 498 |
| A. | 413KJ/mol | B. | 872KJ/mol | C. | 221.6KJ/mol | D. | 436KJ/mol |
| Q | R | ||
| T | W |
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
(3)原子序数比R多1的元素M的一种氢化物能分解为M的另一种氢化物,此分解反应的化学方程式是2H2O2═2H2O+O2↑.
(4)R有多种氧化物,其中甲的相对分子质量最小.在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是NaNO2.
| 序号 | 甲 | 乙 | 丙 |
| ① | CO2 | SO2 | 石灰水 |
| ② | HCl | CO2 | 石灰水 |
| ③ | CO2 | SO2 | Ba(NO3)2 |
| ④ | Cl2 | SO2 | BaCl2 |
| ⑤ | CO2 | NH3 | CaCl2 |
| ⑥ | NO2 | SO2 | BaCl2 |
| A. | ①②③④⑤ | B. | 只有②③④ | C. | 只有①③④ | D. | ①②③④⑥ |
| A. | 氢元素有三种同位素,则氢气分子有三种 | |
| B. | 稀有气体元素原子最外层都达到8电子稳定结构 | |
| C. | 第IA、ⅡA族元素的阳离子与同周期稀有气体元素原子具有相同的核外电子排布 | |
| D. | 将盛有NH4HCO3粉末的小烧杯放人盛有少量醋酸的大烧杯中,然后向小烧杯中加入盐酸,反应剧烈,醋酸逐渐凝固,该反应中,热能转化为产物内部的能量 |
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如表所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1 | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定,而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
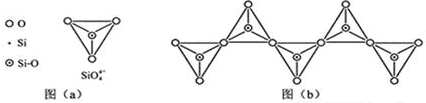
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3,Si与O的原子数之比为1:3,化学式为SiO32-.