题目内容
2.下列实验方案设计中,能达到实验目的是( )| 选项 | 实验目的 | 实验方案 |
| A | 验证苯与液溴在溴化铁催化条件下发生的是取代反应 | 将产生的气体物质通入水中,滴入石蕊试液 |
| B | 检验火柴头中氯元素的存在 | 取几根火柴头浸入水中,片刻后再取少量溶液于试管中,滴加硝酸银溶液和稀硝酸 |
| C | 验证Ksp(AgI)<Ksp(AgCl) | 向1L浓度均为0.5mol•L-1NaCl、KI的混合液中滴加AgNO3溶液 |
| D | 配置0.1000mol•L-1CuSO4溶液 | 将12.00g CuSO4•5H20溶于水配成480mL溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.苯与液溴在溴化铁催化条件下反应生成溴化氢;
B.火柴头浸于水中不含氯离子;
C.滴加少量AgNO3溶液,溶度积小的先沉淀;
D.没有480mL容量瓶.
解答 解:A.苯与液溴在溴化铁催化条件下反应生成溴化氢,溴化氢能使石蕊变紫色,可验证,故A正确;
B.火柴头浸于水中不含氯离子,应将燃尽的火柴头浸泡在少量水中产生氯离子,再加AgNO3溶液和稀HNO3,可以检验火柴头中的氯元素,故B错误;
C.滴加少量AgNO3溶液,溶度积小的先沉淀,则出现黄色沉淀可知Ksp(AgCl)>Ksp(AgI),故C正确;
D.没有480mL容量瓶,应配制500mL溶液,故D错误.
故选AC.
点评 本题考查化学实验方案的评价,涉及物质的检验、沉淀转化以及溶液配制等,为高频考点,题目涉及较广,题目难度中等,答题时注意审题,牢固把握相关基础知识是解答该题的前提.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
12.常温下,向20.00mL 0.100mol/LCH3COONa溶液中逐滴加入0.1 000mol/L盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )

| A. | 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
13.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
| A. | 配制标准溶液的氢氧化钠中混有氯化钠杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 碱式滴定管尖嘴部分的气泡没全部赶跑 |
10.下列叙述正确的是( )
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
18.为了减少温室气体排放,中国政府承诺到2020年我国单位国内生产总值CO2排放比2005年下降40%-45%.目前工业上有采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H.为探究其反应原理进行如下实验,在容积为2L密闭容器内、250℃条件下n(CO2) 和n(H2)随时间的变化情况如下表:
达平衡时反应共放热4.9kJ.根据题目回答下列问题:
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).
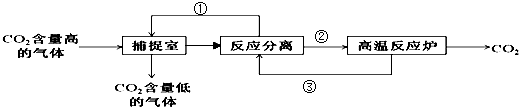
物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).

物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
19. 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,其中Fe2O3是( )
 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:2Al+Fe2O3 $\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,其中Fe2O3是( )
| A. | 氧化剂 | B. | 既是氧化剂又是还原剂 | ||
| C. | 还原剂 | D. | 既不是氧化剂又不是还原剂 |
