题目内容
1.将铁投入到稀硝酸溶液中,会发生如下反应:Fe+4HNO3(稀)═Fe (NO3)3+NO↑+2H2O(1)用双线桥法标出电子转移的方向和数目
(2)已知反应过程中消耗了28g铁,则转移电子的物质的量为1.5mol,被还原的硝酸的物质的量为0.5mol.
(3)请将以上反应改写为离子方程式Fe+4H++NO3-═Fe3++NO↑+2H2O.
分析 Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O中,Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,以此来解答.
解答 解:(1)Fe元素的化合价由0升高为+3价,硝酸中N元素的化合价由+5价降低为+2价,该反应中1molFe反应转移3mol电子,则电子转移方向和数目为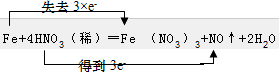 ,故答案为:
,故答案为: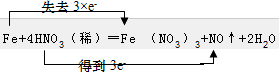 ;
;
(2)n(Fe)=$\frac{28g}{56g/mol}$=0.5mol,Fe元素的化合价由0升高为+3价,则转移电子的物质的量为1.5mol,硝酸中N元素的化合价由+5价降低为+2价,被还原的硝酸的物质的量为0.5mol,
故答案为:1.5 mol;0.5mol;
(3)反应的离子方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,故答案为:Fe+4H++NO3-═Fe3++NO↑+2H2O.
点评 本题考查氧化还原反应,为高考高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念和转移电子的考查,题目难度不大.

练习册系列答案
相关题目
12.常温下,向20.00mL 0.100mol/LCH3COONa溶液中逐滴加入0.1 000mol/L盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的是( )

| A. | 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
9.向2 mL0.5 mol•L-1的FeCl3溶液中加入3 mL 3 mol•L-1的KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色.下列说法正确的是( )
| A. | Fe3+ 不与I-发生反应 | |
| B. | F-使I-的还原性减弱 | |
| C. | Fe3+ 与F-结合成不与I-反应的物质 | |
| D. | Fe3+ 被F-还原为Fe2+使溶液中不再存在Fe3+ |
16.在下列各氧化还原反应中,水既不作氧化剂,也不作还原剂的是( )
| A. | 2F2+2H2O═4HF+O2 | B. | 2Al+2H2O+2NaOH═2NaAlO2+3H2↑ | ||
| C. | 2K+2H2O═2KOH+H2↑ | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
6.下列有关物质的性质与应用不相对应的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
13.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
| A. | 配制标准溶液的氢氧化钠中混有氯化钠杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 碱式滴定管尖嘴部分的气泡没全部赶跑 |
10.下列叙述正确的是( )
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
18.为了减少温室气体排放,中国政府承诺到2020年我国单位国内生产总值CO2排放比2005年下降40%-45%.目前工业上有采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H.为探究其反应原理进行如下实验,在容积为2L密闭容器内、250℃条件下n(CO2) 和n(H2)随时间的变化情况如下表:
达平衡时反应共放热4.9kJ.根据题目回答下列问题:
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).
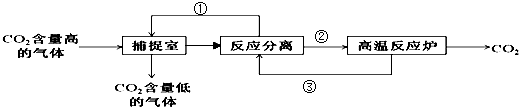
物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).

物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.