题目内容
6.在密闭容器中进行的如下反应:2SO2(g)+O2(g)?2SO3(g)(1)写出反应的平衡常数表达式;
(2)已知某温度下,SO2的起始浓度是0.4mol/L,O2的起始浓度是0.96mol/L.当SO2的转化率为80%时,反应达到平衡状态.计算该温度下的平衡常数.
分析 (1)化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)参加反应的c(SO2)=0.4mol/L×80%=0.32mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L)0.4 0.96 0
反应(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.8 0.32
根据化学平衡常数公式计算该温度下的化学平衡常数K.
解答 解:(1)该反应化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$,
答:该反应化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$;
(2)参加反应的c(SO2)=0.4mol/L×80%=0.32mol/L,
2SO2(g)+O2(g)?2SO3(g)
开始(mol/L)0.4 0.96 0
反应(mol/L)0.32 0.16 0.32
平衡(mol/L)0.08 0.8 0.32
该反应化学平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2}).c({O}_{2})}$=$\frac{0.3{2}^{2}}{0.0{8}^{2}×0.8}$=20,
答:该温度下化学平衡常数K=20.
点评 本题考查化学平衡有关计算,为高频考点,明确化学平衡常数公式含义是解本题关键,注意计算时要用平衡时各物质浓度而不是物质的量.

练习册系列答案
相关题目
9.向2 mL0.5 mol•L-1的FeCl3溶液中加入3 mL 3 mol•L-1的KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色.下列说法正确的是( )
| A. | Fe3+ 不与I-发生反应 | |
| B. | F-使I-的还原性减弱 | |
| C. | Fe3+ 与F-结合成不与I-反应的物质 | |
| D. | Fe3+ 被F-还原为Fe2+使溶液中不再存在Fe3+ |
10.下列叙述正确的是( )
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
18.为了减少温室气体排放,中国政府承诺到2020年我国单位国内生产总值CO2排放比2005年下降40%-45%.目前工业上有采用CO2与H2在CuO-ZnO/ZrO催化下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g)?CH3OH(g)+H2O(g);△H.为探究其反应原理进行如下实验,在容积为2L密闭容器内、250℃条件下n(CO2) 和n(H2)随时间的变化情况如下表:
达平衡时反应共放热4.9kJ.根据题目回答下列问题:
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).
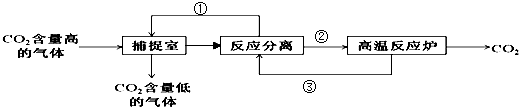
物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.4 | 0.35 | 0.31 | 0.3 | 0.3 | 0.3 |
| n(H2)(mol) | 1.2 | 1.05 | n1 | n2 | n2 | n2 |
(1)n1=0.93,250℃下,该反应的平衡常数K=13.7;△H=-49kJ/mol.
(2)平衡时CO2的转化率是25%.
(3)能说明反应已达平衡状态的是BC.
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是C.
A.及时分离出产物 B.适当升高温度 C.增大CO2浓度 D.选择高效催化剂
(5)“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如可利用NaOH溶液来“捕捉”CO2,其基本过程如图所示,过程中用到生石灰(部分条件及物质未标出).

物质①为NaOH,物质③为CaO,操作②为过滤.整个过程发生的化学反应方程式有:2NaOH+CO2=Na2CO3+H2O,CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
15.对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)+Q(Q>0).
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2}).{c}^{2}(C{O}_{2})}{{c}^{2}(CO).{c}^{2}(NO)}$.
(2)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(3)下列描述中能说明上述反应已达平衡的是bd
a.2υ正(NO)=υ逆(N2) b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大(填“变大”、“不变”或“变小”)
(5)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是②>①>③(填编号);
(6)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀.用电离平衡原理解释上述现象饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀.加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(3)下列描述中能说明上述反应已达平衡的是bd
a.2υ正(NO)=υ逆(N2) b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大(填“变大”、“不变”或“变小”)
(5)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是②>①>③(填编号);
(6)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀.用电离平衡原理解释上述现象饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀.加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
16.每年6月5日为世界环境日.下列有关环保建议不能采纳的是( )
| A. | 开发利用太阳能 | B. | 提倡垃圾分类处理 | ||
| C. | 改进汽车尾气净化技术 | D. | 将工业废水直接排放 |