题目内容
18.已知某种镁铝合金共3g,将此合金放入过量的氢氧化钠溶液中,得到3.36L H2(标准状况).求此合金中铝的质量分数.分析 镁不与氢氧化钠溶液反应,则合金放入过量的氢氧化钠溶液中发生的反应为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据生成氢气的体积可计算出铝的物质的量,再根据m=nM计算出铝的质量,最后计算出合金中铝的质量分数.
解答 解:合金放入过量的氢氧化钠溶液中发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
2mol 67.2L
n(Al) 3.36L
n(Al)=$\frac{2mol×3.36L}{67.2L}$=0.1mol,
则合金中铝的质量为:27g/mol×0.1mol=2.7g,
所以合金中铝的质量分数为:$\frac{2.7g}{3g}$×100%=90%,
答:合金中铝的质量分数为90%.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意熟练掌握镁、铝的化学性质,试题培养了学生的化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.向2 mL0.5 mol•L-1的FeCl3溶液中加入3 mL 3 mol•L-1的KF溶液,FeCl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色.下列说法正确的是( )
| A. | Fe3+ 不与I-发生反应 | |
| B. | F-使I-的还原性减弱 | |
| C. | Fe3+ 与F-结合成不与I-反应的物质 | |
| D. | Fe3+ 被F-还原为Fe2+使溶液中不再存在Fe3+ |
6.下列有关物质的性质与应用不相对应的是( )
| A. | SO2具有氧化性,可用于漂白纸浆 | |
| B. | 淀粉溶液遇碘变成蓝色,可用于检验碘单质的存在 | |
| C. | Fe在常温下遇浓硫酸发生钝化,可用铁制容器盛放冷的浓硫酸 | |
| D. | Zn具有还原性和导电性,可用作锌锰干电池的负极材料 |
13.用标准的NaOH滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定结果偏高的原因可能是( )
| A. | 配制标准溶液的氢氧化钠中混有氯化钠杂质 | |
| B. | 滴定终点读数时,俯视滴定管的刻度,其它操作均正确 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 碱式滴定管尖嘴部分的气泡没全部赶跑 |
3.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时:
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列有关说法正确的是( )
①HF(aq)+OH-(aq)═F-(aq)+H2O(l)△H=-67.7kJ•mol-1
②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列有关说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?F-(aq)+H+(aq)△H=+10.4 kJ•mol-1 | |
| B. | NaF水解时的热化学方程式为F-(aq)+H2O(aq)=HF(aq)+OH-(aq)△H=+67.7KJ•mol | |
| C. | 溶液温度升高后,一定能促进弱电解质的电离 | |
| D. | 将含有0.1molHF与0.1molNaOH的两种物质混合后放出的热量为6.77KJ |
10.下列叙述正确的是( )
| A. | 向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中c(Cl-)+c(H+)<c(NH4+)+c(OH-) | |
| C. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)前者小于后者 | |
| D. | Na2CO3溶液加入少量Ca(OH)2固体,CO32-水解成都减小,溶液的pH减小 |
15.对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的.汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)$\stackrel{催化剂}{?}$ N2(g)+2CO2(g)+Q(Q>0).
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
(1)写出该反应的平衡常数表达式K=$\frac{c({N}_{2}).{c}^{2}(C{O}_{2})}{{c}^{2}(CO).{c}^{2}(NO)}$.
(2)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(3)下列描述中能说明上述反应已达平衡的是bd
a.2υ正(NO)=υ逆(N2) b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大(填“变大”、“不变”或“变小”)
(5)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是②>①>③(填编号);
(6)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀.用电离平衡原理解释上述现象饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀.加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(2)前2s内的平均反应速率υ(N2)=1.875×10-4mol/(L•s);
达到平衡时,CO的转化率为25%.
(3)下列描述中能说明上述反应已达平衡的是bd
a.2υ正(NO)=υ逆(N2) b.容器中气体的平均分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中CO的转化率不再发生变化
(4)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液.往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,$\frac{c(NH_4^+)}{{c(SO_4^{2-})}}$的值将变大(填“变大”、“不变”或“变小”)
(5)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是②>①>③(填编号);
(6)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀.用电离平衡原理解释上述现象饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀.加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生.
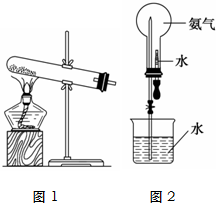 氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示:
氨气是化学实验室常需制取的气体.实验室制取氨气的装置如图1所示: