题目内容
2. 常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH
常温下有0.1mol•L-1四种溶液NaOH、NH3•H2O、HCl、CH3COOH(1)已知CH3COOH溶液的pH=3,其电离度为1%,由水电离的c(H+)=10-11mol•L-1.
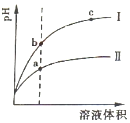
(2)相同pH的CH3COOH溶液和HCl溶液加水稀释,其pH变化情况如图,其中表示HCl溶液的是曲线I,a、b两点中,导电能力更强的是a.
(3)NH3•H2O溶液和HCl溶液混合,已知体积V(NH3•H2O)>V(HCl),当溶液中c(NH3•H2O)=c(NH4+)时,溶液的pH=9.25.[已知:Kb(NH3•H2O)=1.77×10-5,lg 1.77=0.25].
分析 (1)电离度α=$\frac{已电离的醋酸分子}{醋酸分子总数}$×100%;根据溶液中的氢氧根离子计算;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸;
溶液的导电能力与离子浓度成正比;
(3)根据Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$,结合c(NH3•H2O)=c(NH4+)计算.
解答 解:(1)由CH3COOH?CH3COO-+H+知,c(H+)等于已经电离的c(CH3COOH),所以已经电离的醋酸浓度是1.0×10-3mol/L,
所以α=$\frac{已电离的醋酸分子}{醋酸分子总数}$×100%=$\frac{1×1{0}^{-3}mol/L}{0.1mol/L}$×100%=1%;pH=3的醋酸溶液中,c(OH-)=$\frac{1{0}^{-14}}{0.001}$=10-11mol/L,醋酸溶液中氢氧根离子全部由水电离,而由水电离的氢离子等于水电离的氢氧根离子,则由水电离的c(H+)=10-11mol•L-1,;
故答案为:1%;10-11;
(2)pH相等的醋酸和盐酸中,加水稀释促进醋酸电离,稀释相同的倍数后,醋酸中氢离子浓度大于盐酸,所以pH变化大的为强酸,根据图象知,I为盐酸;
溶液的导电能力与离子浓度成正比,氢离子浓度越大溶液的pH越小,所以溶液导电能力较大的是a;
故答案为:?;a;
(3)已知Kb(NH3•H2O)=$\frac{c(N{{H}_{4}}^{+})×c(O{H}^{-})}{(N{H}_{3}•{H}_{2}O)}$=1.77×10-5,又因为c(NH3•H2O)=c(NH4+),则c(OH-)=1.77×10-5,所以c(H+)=$\frac{1{0}^{-14}}{1.77×1{0}^{-5}}$,则pH=9.25;
故答案为:9.25.
点评 本题考查了弱电解质的电离,根据弱电解质电离特点结合电荷守恒、物料守恒来分析解答,难点是(3)题,根据电离平衡常数计算,题目难度中等,侧重于考查学生的分析能力和计算能力.

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案| A. | 氧化铝 | B. | 氢氧化铝 | C. | 铝 | D. | 碳酸氢钠 |
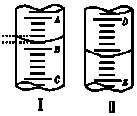 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
| A. | 聚丙烯的结构简式为: | B. | 丙烷分子的球棍模型为: | ||
| C. | 四氯化碳分子的电子式为: | D. | 苯的最简式为C6H6 |
| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
| 物 质 | 所需试剂 | 离子方程式 |
| FeSO4(CuSO4) | ||
| Na2SO4(NaHCO3) | . |
I、已知2NO(g)+O2(g)═2NO2(g)△H=b kJ•mol-1;CO的燃烧热△H=c kJ•mol-1.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1.
II、一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

(2)前2s内的平均反应速率υ(N2)=0.09mol/(L•s)(保留两位小数,下同);此温度下,该反应的平衡常数为0.03mol•L-1.
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,
①常温条件下,此溶液的PH=5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×104(已知该温度下NH3•H2O的Kb=1.7×10-5)
②向此溶液中再加入少量 (NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大(填“变大”、“不变”或“变小”)
(4)设计如图1装置模拟传感器测定CO与 NO反应原理.
①铂电极为正极(填“正极”或“负极”).
②负极电极反应式为CO+O2--2e-=CO2
III、如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.
