��Ŀ����
3���������������Դ���й����Ŀ�����Ӧ��ǰ�����ɼ�����Ⱦ����������⣮�״���һ�ֿ������������Դ��һ����������CO��H2�ϳ�CH3OH��CO��g��+2H2 ��g��?CH3OH��g����H=-105kJ•mol-1�������Ϊ2L���ܱ������г���2mol CO��4mol H2����ò�ͬ�¶��������ڵ�ѹǿ��P��kPa����ʱ�䣨min���ı仯��ϵ��ͼ1�Т�������ʾ��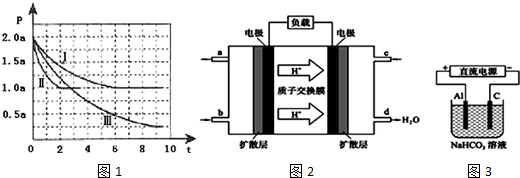
��1���٢�͢���ȣ��ı�ķ�Ӧ�����Ǣ���ʹ�ô�����
�ڷ�Ӧ����6minʱ�ﵽƽ�⣬�ڴ������´ӷ�Ӧ��ʼ���ﵽƽ��ʱv ��CH3OH��=0.125 mol/��L��min����
�۷�Ӧ����2minʱ�ﵽƽ�⣬ƽ�ⳣ��K����=12����������¶Ȳ���������£���������Ӧ�ﵽƽ���ʱ�����������м���1mol CO��3mol CH3OH��v������= v���棩�����������������=������ԭ����Ũ����Qc=$\frac{\frac{1.5+3}{2}}{\frac{1+0.5}{2}��0��{5}^{2}}$=12=K�����淴Ӧ����ƽ��״̬��
�ܱȽϷ�Ӧ����¶ȣ�T1���ͷ�Ӧ����¶ȣ�T3���ĸߵͣ�T1��T3���������������=�������жϵ������Ǵ˷�ӦΪ���ȷ�Ӧ�������¶ȣ���Ӧ���ʼ�����ƽ��������Ӧ�����ƶ���
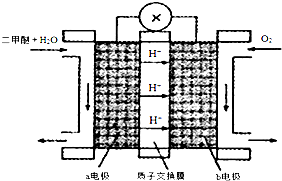
��2��ij�о�����װ��CH3OH-O2ȼ�ϵ�صĹ���ԭ����ͼ2��ʾ��
�ٸõ�ظ����ĵ缫��ӦʽΪ��CH3OH-6e-+H2O=CO2��+6H+����
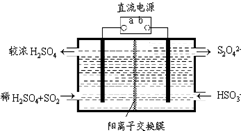
���Դ˵������Դ���е�⣬װ����ͼ3��ʾ��������Һ����Dz������ݲ�������ԭ����Al-3e-=Al3+��Al3++3HCO3-=Al��OH��3��+3CO2����������ص����ӷ���ʽ��ʾ����
���� ��1���٢�͢���ȷ�Ӧ���ʼӿ죬��Ӱ��ƽ���ƶ�������ӦΪ�������ʵ�����С�ķ�Ӧ��Ӧ��ʹ�ô�����
�ں��º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ������������ʵ���Ϊ��2+4��mol��$\frac{1.0aKPa}{2.0aKPa}$=3mol����
CO��g��+2H2 ��g��?CH3OH��g�����ʵ�����С��n=2
��ʼ����mol����2 4 0
�仯����mol����1.5 3 1.5 6-3=3
ƽ������mol����0.5 1 1.5
�ٸ���v=$\frac{��c}{��t}$����v��CH3OH����
�ۢ��¶���ͬ��ƽ�ⳣ����ͬ������K=$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$����ƽ�ⳣ����
�����ʱŨ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У�
�ܷ�Ӧ���ƽ��ʱ���õ�ʱ��ȷ�Ӧ���ƽ��ʱ���õ�ʱ�䳤����ѧ��Ӧ���ʿ죬�Ң�ƽ��ʱѹǿ��IС����I���ƽ�������ƶ�������ӦΪ���������С���ȷ�Ӧ��Ӧ�����¶ȣ�
��2���ټ״�����������Ӧ���ڸ�����Ӧ����Һ��ʧ�������ɶ�����̼���ݴ���д�缫��Ӧ���ٴ��������ƶ���������������������ڷ�Ӧ��ע�����������Եģ�
����������ʧ�������������ӣ������Ӻ�̼��������ӷ���˫ˮ�ⷴӦ��
��� �⣺��1���٢�͢���ȷ�Ӧ���ʼӿ죬��Ӱ��ƽ���ƶ�������ӦΪ�������ʵ�����С�ķ�Ӧ��Ӧ��ʹ�ô�����
�ʴ�Ϊ������ʹ�ô�����
�ں��º����£�ѹǿ֮�ȵ����������ʵ���֮�ȣ���ƽ��ʱ������������ʵ���Ϊ��2+4��mol��$\frac{1.0aKPa}{2.0aKPa}$=3mol����
CO��g��+2H2 ��g��?CH3OH��g�����ʵ�����С��n=2
��ʼ����mol����2 4 0
�仯����mol����1.5 3 1.5 6-3=3
ƽ������mol����0.5 1 1.5
��v��CH3OH��=$\frac{\frac{1.5mol}{2L}}{6min}$=0.125 mol/��L��min����
�ʴ�Ϊ��0.125 mol/��L��min����
�ۢ��¶���ͬ��ƽ�ⳣ����ͬ��ƽ�ⳣ��K����=$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$=$\frac{\frac{1.5}{2}}{\frac{0.5}{2}����\frac{1}{2}��^{2}}$=12��
��ʱŨ����Qc=$\frac{\frac{1.5+3}{2}}{\frac{1+0.5}{2}��0��{5}^{2}}$=12=K������ƽ��״̬����v������=v ���棩��
�ʴ�Ϊ��12��=��Ũ����Qc=$\frac{\frac{1.5+3}{2}}{\frac{1+0.5}{2}��0��{5}^{2}}$=12=K�����淴Ӧ����ƽ��״̬��
�ܷ�Ӧ���ƽ��ʱ���õ�ʱ��ȷ�Ӧ���ƽ��ʱ���õ�ʱ�䳤����ѧ��Ӧ���ʿ죬�Ң�ƽ��ʱѹǿ��IС����I���ƽ�������ƶ�������ӦΪ���������С���ȷ�Ӧ��Ӧ�����¶ȣ����¶�T1�¶ȸ��ߣ�
�ʴ�Ϊ�������˷�ӦΪ���ȷ�Ӧ�������¶ȣ���Ӧ���ʼ�����ƽ��������Ӧ�����ƶ���
��2����H�����ƶ���˵������ĵ缫���������ʼ״�Ӧ��bҲ���Ǹ���ͨ�룮����ʧ�������ɶ�����̼����������Ӧ�������缫��ӦΪ��CH3OH-6e-+H2O=CO2��+6H+��������������Ӧ�������������£��缫��ӦʽӦΪ��O2+4e-+4H+=2H2O��
�ʴ�Ϊ��CH3OH-6e-+H2O=CO2��+6H+��
�����������������ϵ缫��ӦʽΪAl=Al3++3e-�����������ɵ������Ӻ�̼��������ӷ���˫ˮ�ⷴӦ�����������������Ͷ�����̼���壬������Һ�����Al3++3HCO3-=Al��OH��3��+3CO2����
�ʴ�Ϊ��Al-3e-=Al3+��Al3++3HCO3-=Al��OH��3��+3CO2����
���� ���⿼�黯ѧƽ�������Ӱ�����ء���ѧƽ��ͼ��Ӧ������ƽ�ⳣ����ԭ���ԭ���ȣ��������ջ�ѧƽ�ⳣ��Ӧ�ã��Ѷ��еȣ�

| A�� | �����Ʊ�ʾ�����ں��ⵥλ����Ŀռ���ֵĻ������ | |
| B�� | ͬһԭ�Ӵ��ڼ���̬ʱ������һ�����ڻ�̬ʱ������ | |
| C�� | ���ܼ�������ԭ�ӹ������s��p��d��f��˳������Ϊ1��3��5��7 | |
| D�� | 1��ԭ�ӹ�������ֻ������2�����ӣ�������������ͬ |
| A�� | Na+��Ba2+��NO3-��Cl- | B�� | K+��Na+��H+��Cl- | ||
| C�� | K+��NH4+��S2-��CO32- | D�� | Cu2+��Na+��Cl-��SO42- |
I����֪2NO��g��+O2��g���T2NO2��g����H=b kJ•mol-1��CO��ȼ���ȡ�H=c kJ•mol-1��д����������β����NO2����Ⱦʱ��NO2��CO��Ӧ���Ȼ�ѧ����ʽ2NO2��g��+4CO��g��=N2��g��+4CO2��g����H=a-b+2c kJ•mol-1��
II��һ�������£���һ�ܱ������У��ô�������ø÷�Ӧ�ڲ�ͬʱ���NO��COŨ�������
| ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c��NO��/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c��CO��/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

��2��ǰ2s�ڵ�ƽ����Ӧ���ʦԣ�N2��=0.09mol/��L•s����������λС������ͬ�������¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ0.03mol•L-1��
��3�����õ��³���������������������ͬʱ����SO2��NOx����ã�NH4��2SO4��ϡ��Һ��
�ٳ��������£�����Һ��PH=5����$\frac{c��N{{H}_{4}}^{+}��}{c��N{H}_{3}•{H}_{2}O��}$=1.7��104����֪���¶���NH3•H2O��Kb=1.7��10-5��
�������Һ���ټ������� ��NH4��2SO4���壬$\frac{c��N{{H}_{4}}^{+}��}{c��S{{O}_{4}}^{2-}��}$��ֵ��������������䡱��С����
��4�������ͼ1װ��ģ������ⶨCO�� NO��Ӧԭ����
�ٲ��缫Ϊ�����������������������
�ڸ����缫��ӦʽΪCO+O2--2e-=CO2
III����ͼ2��ʾ����Ħ�����������Ļ���1��2����Ӧ�����ɼס��������֣���25���101kPa��ʵ��ƽ��ʱ������������ֱ�ΪV����V������ʱ��ȥ������1�����������2���ƶ�����x=1.5��V����V��=3��1��
��CO��g��+2H2��g��?CH3OH��g����H1=-90.7kJ•mol-1
��2CH3OH��g��?CH3OCH3��g��+H2O��g����H2=-23.5k1•mol-1
��CO��g��+H2O��g��?CO2��g��+H2��g����H3=-41.2kJ•mol-1
��1������Ӧ�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ3CO��g��+3H2��g��?CH3OCH3��g��+CO2��g����H=-246.1kJ•mol-1��
830��ʱ��Ӧ�۵�K=1.0�����ڴ���Ӧ���з�Ӧ�۵�K��1.0�����������������=������
��2����ij�¶��£�����Ӧ�ٵ���ʼŨ�ȷֱ�Ϊ��c��CO��=1mol/L��c��H2��=2.4mol/L��5min��ﵽƽ�⡢CO��ת����Ϊ50%����5min��CO��ƽ����Ӧ����Ϊ0.1mol/��L•min����
��3����Ӧ��2CH3OH��g���TCH3OCH3��g��+H2O��g�� ��ij�¶��µ�ƽ�ⳣ��Ϊ400�����¶��£����ܱ������м���CH3OH����Ӧ��ijʱ�̲�ø���ֵ�Ũ�����£�
| ���� | CH3OH | CH3OCH3 | H2O |
| Ũ��/��mol•L-1�� | 0.64 | 0.50 | 0.50 |
��������CH3OH��10min��Ӧ�ﵽƽ�⣬��ʱc��CH3OH��=0.04mol•L-1��
��4����������ȼ�ϵ�ء���һ����ɫ��Դ�����й���ԭ����ͼ��ʾ��
�ٸõ��a�缫�Ϸ����ĵ缫��ӦʽCH3OCH3+3H2O-12e-=2CO2+12H+��
������øõ����Ϊ���װ�ã�����23g�����ѷ�����Ӧʱ�����������ṩ�ĵ�������ʽΪ0.5mol��12��1.6��10-19C��6.02��1023
mol-1C ��1�����ӵĵ���Ϊ1.6��10-19C����

| A�� | T1��T2��Q��0 | |
| B�� | ����ѹǿ��B��ת���ʼ�С | |
| C�� | �����������ܶȲ��ٱ仯����Ӧ��ƽ��״̬ | |
| D�� | a+b��c+d |
 ��������������ж��֣�����SO2��NOx���Ǵ�����Ⱦ������ǵ��о������ڿ����ľ�����
��������������ж��֣�����SO2��NOx���Ǵ�����Ⱦ������ǵ��о������ڿ����ľ�����