题目内容
3. 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.(1)从反应开始到平衡,氢气的平均反应速率v(H2)=0.225mol/(L•min);
(2)氢气的转化率=75%;
(3)该反应的平衡常数为5.33(保留小数点后2位);
(4)下列措施中能使平衡体系中n(CH3OH)/n(CO2)增大的是C.
A.升高温度 B.充入He(g),使体系压强增大 C.再充入1mol H2.
分析 (1)根据v=$\frac{△c}{△t}$计算;
(2)根据氢气的平衡浓度判断转化的物质的量,进而可计算转化率;
(3)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动.
解答 解:(1)利用三段式解题法计算
CO2(g)+3H2(g)?CH3OH(g)+H2O(g),
开始(mol/L):1 3 0 0
变化(mol/L):0.75 2.25 0.75 0.75
平衡(mol/L):0.25 0.75 0.75 0.75
从反应开始到平衡,氢气的平均反应速率v(H2)=$\frac{2.25mol/L}{10min}$=0.225 mol•L-1•min-1,
故答案为:0.225;
(2)氢气的转化率=$\frac{2.25}{3}$=75%,
故答案为:75%;
(3)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{c(C{H}_{3}OH)c({H}_{2}O)}{c(C{O}_{2}){c}^{3}({H}_{2})}$=$\frac{0.75×0.75}{0.25×0.7{5}^{3}}$=5.33,
故答案为:5.33;
(4)要使n(CH3OH)/n(CO2)增大,应使平衡向正反应方向移动,
A.因正反应放热,升高温度平衡向逆反应方向移动,则n(CH3OH)/n(CO2)减小,故A错误;
B.充入He(g),使体系压强增大,但对反应物质来说,浓度没有变化,平衡不移动,n(CH3OH)/n(CO2)不变,故B错误;
C.再充入1mol H2,平衡向正反应方法移动,n(CH3OH)/n(CO2)增大,故C正确;
故答案为:C.
点评 本题考查较为综合,涉及化学平衡计算以及平衡移动等问题,题目难度较大,注意根据图象计算各物质的平衡浓度为解答该题的关键.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案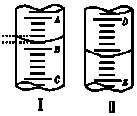 如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )
如图,图Ⅰ表示10mL量筒中液面的位置,A与B、B与C刻度间相差1mL,图II表示50mL滴定管中液面的位置,D 与E刻度间相差1mL.如果刻度A和D都是10,则两处液面的读数是( )| A. | Ⅰ中是9.2mL,Ⅱ中是9.40mL | B. | Ⅰ中是10.8mL,Ⅱ中是9.40mL | ||
| C. | Ⅰ中是10.8mL,Ⅱ中是10.60mL | D. | Ⅰ中是9.2mL,Ⅱ中是10.60mL |
| 物 质 | 所需试剂 | 离子方程式 |
| FeSO4(CuSO4) | ||
| Na2SO4(NaHCO3) | . |
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡时体系能量的变化 | ||
| A | B | C | ||
| ① | 2 | 1 | 0 | 0.75Q kJ |
| ② | 0.4 | 0.2 | 1.6 | |
| A. | 容器①、②中反应的平衡常数均为36 | |
| B. | 容器②中反应达到平衡时放出的热量为0.05QkJ 达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol•L-1 | |
| C. | 向容器①中通入氦气,平衡时A的转化率不变 | |
| D. | 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于$\frac{2}{3}$ |
| A. | 电子云表示电子在核外单位体积的空间出现的机会多少 | |
| B. | 同一原子处于激发态时的能量一定高于基态时的能量 | |
| C. | 各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7 | |
| D. | 1个原子轨道里最多只能容纳2个电子,且自旋方向相同 |
I、已知2NO(g)+O2(g)═2NO2(g)△H=b kJ•mol-1;CO的燃烧热△H=c kJ•mol-1.写出消除汽车尾气中NO2的污染时,NO2与CO反应的热化学方程式2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=a-b+2c kJ•mol-1.
II、一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

(2)前2s内的平均反应速率υ(N2)=0.09mol/(L•s)(保留两位小数,下同);此温度下,该反应的平衡常数为0.03mol•L-1.
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,
①常温条件下,此溶液的PH=5,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=1.7×104(已知该温度下NH3•H2O的Kb=1.7×10-5)
②向此溶液中再加入少量 (NH4)2SO4固体,$\frac{c(N{{H}_{4}}^{+})}{c(S{{O}_{4}}^{2-})}$的值将变大(填“变大”、“不变”或“变小”)
(4)设计如图1装置模拟传感器测定CO与 NO反应原理.
①铂电极为正极(填“正极”或“负极”).
②负极电极反应式为CO+O2--2e-=CO2
III、如图2所示,无摩擦、无质量的活塞1、2将反应器隔成甲、乙两部分,在25℃和101kPa下实现平衡时,各部分体积分别为V甲、V乙.此时若去掉活塞1,不引起活塞2的移动.则x=1.5,V甲:V乙=3:1.
 分子中在同一平面的碳原子数最多有( )
分子中在同一平面的碳原子数最多有( )| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
