题目内容
5.下列关于元素周期表的说法正确的是( )| A. | 元素周期表是按照元素相对原子质量大小排列而成的 | |
| B. | 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多 |
分析 周元素周期表是按照元素核电荷数的大小排列而成的,期表有7个周期,7个主族、7个副族、1个0族、1个第ⅤⅢ族,短周期为1、2、3周期,第ⅠA族H为非金属,以此来解答.
解答 解:A.元素周期表是按照元素核电荷数的大小排列而成的,故A错误;
B.元素周期表有18个纵行,7个主族、7个副族、1个0族、1个第ⅤⅢ族,故B错误;
C.第一周期从左到右的顺序原子最外层电子数由1递增到2,故C错误;
D.周期数与核外电子层有关,同一主族元素从上到下电子层数逐渐增多,故D正确.
故选D.
点评 本题考查元素周期表知识,为高频考点,侧重于双基的考查,有利于培养学生良好的素养,难度不大,注意相关基础知识的积累.

练习册系列答案
 互动课堂系列答案
互动课堂系列答案
相关题目
15.Cu2O为暗红色固体,有毒,它是一种用途广泛的材料.
已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O
②部分难溶物的颜色和常温下的Ksp如下表所示:
某同学利用乙醛与新制氢氧化铜加热制得砖红色沉淀.
(1)乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
(2)砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
(3)砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O
②部分难溶物的颜色和常温下的Ksp如下表所示:
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
(1)乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
(2)砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
(3)砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
16.为测定碱式碳酸钴[COx(OH)y(CO3)z]的化学组成,研究性学习小组的同学设计了如图所示的装置进行实验探究.已知:碱式碳酸钴受热时可分解生成三种氧化物.
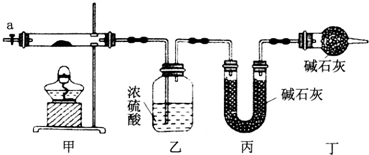
(1)按如图所示装置组装好仪器,并检验装置的气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:
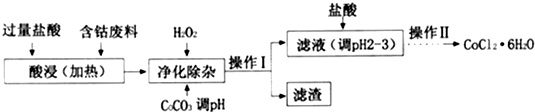
已知:25℃时
①净化除杂时,加入H2O2发生反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2--3的目的为抑制CoCl2的水解.

(1)按如图所示装置组装好仪器,并检验装置的气密性;称取3.65g样品置于硬质玻璃管内,加热,当乙装置中不再有气泡产生(填实验现象),停止加热;打开活塞a,缓缓通入空气数分钟,通入空气的目的是将装置中生成的CO2和H2O全部排入乙、丙装置中.
(2)某同学认为上述实验中存在一个缺陷,该缺陷是未考虑空气中的水蒸气和二氧化碳对实验的影响.
(3)通过正确实验测得乙、丙装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为Co3(OH)4(CO3)2.
(4)CoCl2•6H2O常用作多彩水泥的添加剂.以含钴废料(含少量Fe、Al等杂质)制取CoCl2•6H2O的一种工艺如下:

已知:25℃时
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CO(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3和Al(OH)3;
③加盐酸调整pH为2--3的目的为抑制CoCl2的水解.
20.下列变化过程中,不能用化学平衡移动原理解释的是( )
| A. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液颜色变深 | |
| C. | 红棕色的NO2加压后颜色先变深后逐渐变浅 | |
| D. | 氯气中混有氯化氢,可通过饱和NaCl溶液除去 |
10.下列离子方程式正确的是( )
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
17. 近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )
近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )
 近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )
近年来江南地区多次发生断肠草被当作“金银花”误食而使人中毒致死的事件.断肠 草为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式.下列有关说法正确的是( )| A. | ②中所含官能团种类比③中多 | |
| B. | ①、④互为同系物 | |
| C. | ①、②、③、④均由C、H、O三种元素组成 | |
| D. | 等物质的量的②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少 |
14.下列物质对应的电子式书写正确的是( )
| A. | NH4Br: | B. | CaCl2: | C. | N2:N??N | D. | Na2O2: |
15.下列离子方程式书写正确的是( )
| A. | AgNO3溶液中滴入少量的Na2S溶液 2Ag NO3+S2-=Ag2S↓+2NO3- | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHCO3溶液 2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
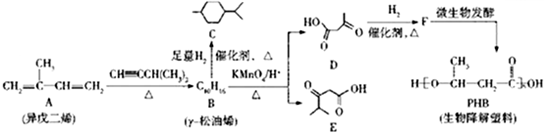
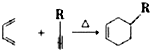
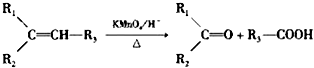
 .反应类型为加成反应或还原反应.
.反应类型为加成反应或还原反应.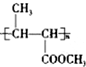 的合成路线
的合成路线 .
.