题目内容
15.下列离子方程式书写正确的是( )| A. | AgNO3溶液中滴入少量的Na2S溶液 2Ag NO3+S2-=Ag2S↓+2NO3- | |
| B. | 过量CO2通入Ca(ClO)2溶液中 ClO-+CO2+H2O=HCO3-+HClO | |
| C. | 向Na2CO3溶液中加入过量CH3COOH溶液 CO32-+2H+=CO2↑+H2O | |
| D. | 向Ba(OH)2溶液中加入少量NaHCO3溶液 2HCO3-+Ba2++2OH-=BaCO3↓+CO32-+2H2O |
分析 A.硝酸银为易溶物,离子方程式中应该拆开;
B.二氧化碳过量,反应生成碳酸氢钙和次氯酸;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.碳酸氢钠少量,反应生成氢氧化钠、碳酸钡沉淀和水.
解答 解:A.AgNO3溶液中滴入少量的Na2S溶液,反应生成硫化银沉淀,正确的离子方程式为:2Ag++S2-=Ag2S↓,故A错误;
B.过量CO2通入Ca(ClO)2溶液中生成碳酸氢钙和次氯酸,反应的离子方程式为:ClO-+CO2+H2O=HCO3-+HClO,故B正确;
C.向Na2CO3溶液中加入过量CH3COOH溶液,醋酸需要保留分子式,正确的离子方程式为:CO32-+2CH3COOH=CO2↑+H2O+2CH3COO-,故C错误;
D.Ba(OH)2溶液中加入少量NaHCO3溶液,碳酸氢根离子完全转化成碳酸钡沉淀,正确的离子方程式为:HCO3-+Ba2++OH-=BaCO3↓+H2O,故D错误;
故选B.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
相关题目
5.下列关于元素周期表的说法正确的是( )
| A. | 元素周期表是按照元素相对原子质量大小排列而成的 | |
| B. | 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多 |
6.下列说法正确的是( )
| A. | 22.4L N2的物质的量为1mol | |
| B. | 标准状况下,1mol任何物质的体积为22.4L | |
| C. | SO2的摩尔质量与相对分子质量相等 | |
| D. | 在相同温度、压强下,相同体积的任何气体分子数相同 |
10.已知某元素的化合价为+7价,下列说法中正确的是( )
| A. | 该元素在元素周期表中一定处于ⅦA族 | |
| B. | 该元素可能是氟元素 | |
| C. | 该元素的某种化合物可能具有漂白性 | |
| D. | 该元素的单质一定是非金属 |
20. 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
(1)NaCN溶液中各离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+).
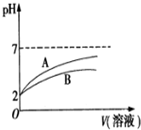
已知NaCN遇酸能产生HCN;25℃时,HCN的电离常数Ka=6.2×10-10 mol•L-1;CH3COOH的电离常数Ka=1.7×10-5 mol•L-1.体积均为100mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶的pH变化趋势的曲线是A(选填“A”或“B”);相同条件下,NaCN溶液的pH>(选填“>”、“=”或“<”)CH3COONa溶液的pH.
(2)200℃固体硝酸铵可以分解为N2O和H2O,此过程中每转移电子8mol放出热量84.8kJ,写出此反应的热化学方程式NH4NO3(s)=N2O(g)+2H2O(g)△H=-42.4 kJ•mol-1.
(3)工业上用氯气和二氧化钛制备TiCl4,一定条件下发生反应:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g);△H>0.此温度下,该反应的平衡常数为400,在密闭容器中加入TiO2(s)和Cl2(g),反应到t时刻测得各组分的浓度如表所示:
①根据表中数据判断t时刻此反应向正反应方向进行(选填“正”或“逆”).
②若经10min反应达到平衡,则该时间内反应速率v(Cl2)=0.16mol•L-1•min-1;下列措施中,可以使平衡向右移动的是d(选填序号).
a.使用催化剂b.增大压强c.减小压强d.升高温度.
 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.(1)NaCN溶液中各离子浓度大小关系为c(Na+)>c(CN-)>c(OH-)>c(H+).
已知NaCN遇酸能产生HCN;25℃时,HCN的电离常数Ka=6.2×10-10 mol•L-1;CH3COOH的电离常数Ka=1.7×10-5 mol•L-1.体积均为100mL、pH=2的CH3COOH溶液和HCN溶液,加水稀释过程中溶液的pH变化与溶液体积的关系如图所示,则表示CH3COOH溶的pH变化趋势的曲线是A(选填“A”或“B”);相同条件下,NaCN溶液的pH>(选填“>”、“=”或“<”)CH3COONa溶液的pH.
(2)200℃固体硝酸铵可以分解为N2O和H2O,此过程中每转移电子8mol放出热量84.8kJ,写出此反应的热化学方程式NH4NO3(s)=N2O(g)+2H2O(g)△H=-42.4 kJ•mol-1.
(3)工业上用氯气和二氧化钛制备TiCl4,一定条件下发生反应:
TiO2(s)+2Cl2(g)═TiCl4(g)+O2(g);△H>0.此温度下,该反应的平衡常数为400,在密闭容器中加入TiO2(s)和Cl2(g),反应到t时刻测得各组分的浓度如表所示:
| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
②若经10min反应达到平衡,则该时间内反应速率v(Cl2)=0.16mol•L-1•min-1;下列措施中,可以使平衡向右移动的是d(选填序号).
a.使用催化剂b.增大压强c.减小压强d.升高温度.
4.下列各组物质不属于同素异形体的是( )
| A. | CO、CO2 | B. | O2、O3 | C. | 红磷、白磷 | D. | 金刚石、石墨 |
5.下列有关的化学史实描述错误的是( )
| A. | 中国化学家侯德榜研究了“侯氏联合制碱法”,为我国化工发展做出贡献 | |
| B. | 瑞典化学家舍勒发现软锰矿(含MnO2)与浓盐酸混合加热制得氯气 | |
| C. | 意大利物理甲阿伏伽德罗发现当光束通过胶体时可见一条光路 | |
| D. | 德国化学家哈伯在合成氨的研究中做出了巨大贡献 |
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题:
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含有少量还原性的杂质气体,由此他提出必须先除去,再与溴水反应.请你回答下列问题: