题目内容
15.Cu2O为暗红色固体,有毒,它是一种用途广泛的材料.已知:①Cu2O溶于硫酸,立即发生反应:Cu2O+2H+=Cu2++Cu+H2O
②部分难溶物的颜色和常温下的Ksp如下表所示:
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
(1)乙醛与新制氢氧化铜反应生成砖红色沉淀的化学方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O.
(2)砖红色沉淀加入稀硫酸,现象为溶液由无色变为蓝色,有红色不溶物.
(3)砖红色沉淀加入浓盐酸,完全溶解得到无色溶液;若改加稀盐酸,则得到白色沉淀,其离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O.
分析 (1)乙醛能被新制氢氧化铜氧化成乙酸,同时生成氧化亚铜;
(2)砖红色沉淀为氧化亚铜,氧化亚铜在稀硫酸溶液中发生自身氧化还原生成硫酸铜和铜单质;
(3)氧化亚铜与稀盐酸反应生成氯化亚铜白色沉淀.
解答 解:(1)乙醛能被新制氢氧化铜氧化成乙酸,同时生成氧化亚铜,反应的方程式为2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O,
故答案为:2Cu(OH)2+NaOH+CH3CHO$\frac{\underline{\;\;△\;\;}}{\;}$Cu2O↓+CH3COONa+3H2O;
(2)砖红色沉淀为氧化亚铜,氧化亚铜在稀硫酸溶液中发生自身氧化还原生成硫酸铜和铜单质,所以反应现象为溶液由无色变为蓝色,有红色不溶物,
故答案为:溶液由无色变为蓝色,有红色不溶物;
(3)氧化亚铜与稀盐酸反应生成氯化亚铜白色沉淀,反应的离子方程式为Cu2O+2H++2Clˉ=2CuCl↓+H2O,
故答案为:Cu2O+2H++2Clˉ=2CuCl↓+H2O.
点评 本题考查了铜及其化合物性质的分析判断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质,掌握基础以及灵活运用题中信息是解题的关键,题目难度中等.

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
6.升高温度,下列溶液的pH不发生变化的是( )
| A. | 0.05mol•L-1的H2SO4 | B. | 0.1mol•L-1的KNO3 | ||
| C. | 0.1mol•L-1的KOH | D. | 0.1mol•L-1的NH4NO3 |
3.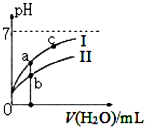 己知:下表为25℃时某些弱酸的电离平衡常数.
己知:下表为25℃时某些弱酸的电离平衡常数.
如图表示常温下,稀释CH3COOH、HCl0两种酸的稀溶液时,溶液pH随加水量的变化.下列说法不正确的是( )
 己知:下表为25℃时某些弱酸的电离平衡常数.
己知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 图中c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HCIO) | |
| B. | pH相同的四种溶液浓度关系:c(CH3COONa>c(NaHC03>c(NaClO>c(Na2C03) | |
| C. | 图中a点酸的总浓度小于b点酸的总浓度 | |
| D. | 浓度均为0.l mol/L的CH3COONa和NaCIO的混合溶液中:c(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH) |
7.下列各组中的反应,属于同一反应类型的是( )
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由苯硝化制硝基苯;由乙醇氧化制乙醛 | |
| C. | 由乙酸和乙醇制乙酸乙酯;由乙酸乙酯水解制乙醇 | |
| D. | 由氯代乙烷制乙烯;由丙烯制1,2-二溴丙烷 |
5.下列关于元素周期表的说法正确的是( )
| A. | 元素周期表是按照元素相对原子质量大小排列而成的 | |
| B. | 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多 |
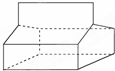 篮烷的结构如图所示:
篮烷的结构如图所示: