题目内容
20.下列变化过程中,不能用化学平衡移动原理解释的是( )| A. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液颜色变深 | |
| C. | 红棕色的NO2加压后颜色先变深后逐渐变浅 | |
| D. | 氯气中混有氯化氢,可通过饱和NaCl溶液除去 |
分析 勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动,使用勒夏特列原理时,该反应必须是可逆反应,否则勒夏特列原理不适用.
解答 解:A.可逆反应为H2(g)+I2(g)?2HI(g),增大压强I2的浓度增大,颜色加深,反应前后气体的体积不发生变化,增大压强平衡不移动,故A正确;
B.铬酸根在酸性环境下可以变成重铬酸根,实质是:2CrO42-+2H+?Cr2O72-+H2O,黄色溶液逐渐变成橙色,溶液颜色变深,化学平衡发生移动,故B错误;
C.可逆反应2NO2(g)?N2O4(g),正反应为体积缩小的反应,加压后二氧化氮的浓度增大,所以气体有色加深,由于增大了压强,平衡向生成四氧化二氮的方向移动,故加压后颜色先变深后变浅,可以平衡移动原理解释,化学平衡发生移动,故C错误;
D、氯气溶于水发生Cl2+H2O?H++Cl-+HClO,饱和食盐水中氯离子浓度较大,抑制氯气的溶解,能用勒夏特列原理解释,故D错误;
故选A.
点评 本题考查了化学平衡影响因素的分析判断,主要是浓度变化和平衡移动的理解应用,注意可逆反应为H2(g)+I2(g)?2HI(g)反应前后气体体积不变的反应,题目难度中等.

练习册系列答案
相关题目
11.下列说法正确的是( )
| A. | 有机物CH2Cl-CH2Cl用系统命名法命名为:二氯乙烷 | |
| B. | 1mol 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol 与足量的NaOH溶液充分反应,消耗NaOH的物质的量为3mol | |
| C. | 标准状况下,22.4L己烷所含分子数为NA | |
| D. | 乙醇与乙酸发生酯化反应时,乙醇分子中的碳氧键没断裂 |
8.下列系统命名法正确的是( )
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4-二乙基-4-戊烯 | ||
| C. | 2-甲基-3-丁炔 | D. | 对二甲苯 |
5.下列关于元素周期表的说法正确的是( )
| A. | 元素周期表是按照元素相对原子质量大小排列而成的 | |
| B. | 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多 |
10.已知某元素的化合价为+7价,下列说法中正确的是( )
| A. | 该元素在元素周期表中一定处于ⅦA族 | |
| B. | 该元素可能是氟元素 | |
| C. | 该元素的某种化合物可能具有漂白性 | |
| D. | 该元素的单质一定是非金属 |
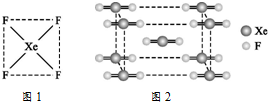 自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.
自从英国化学家巴特列(N.Bartlett)首次合成了第一种稀有气体的化合物XePtF6以来,人们又相继发现了氙的一系列化合物,如XeF2、XeF4等.巴特列为开拓稀有气体化学作出了历史性贡献.