��Ŀ����
��֪��25��Cʱ��A�����ҺpH=a��B�����ҺpH=b��
��1����AΪ���ᣬBΪ�����������������Ϊ1��10��Ϻ���Һ�����ԣ���a+b= ��
��2����AΪ���ᣬB Ϊ�������ƣ���a+b=14�������ΪVA�Ĵ�������ΪVB������������Һ��Ϻ���Һ�����ԣ����������ϵVA VB��
��3����A�Ļ�ѧʽΪHR��B �Ļ�ѧʽΪMOH����a+b=14�����ߵ������Ϻ���Һ�Լ��ԣ�������Һ�бض���һ�������ܷ���ˮ�⣬��ˮ�ⷴӦ�����ӷ���ʽΪ ��
��1����AΪ���ᣬBΪ�����������������Ϊ1��10��Ϻ���Һ�����ԣ���a+b=
��2����AΪ���ᣬB Ϊ�������ƣ���a+b=14�������ΪVA�Ĵ�������ΪVB������������Һ��Ϻ���Һ�����ԣ����������ϵVA
��3����A�Ļ�ѧʽΪHR��B �Ļ�ѧʽΪMOH����a+b=14�����ߵ������Ϻ���Һ�Լ��ԣ�������Һ�бض���һ�������ܷ���ˮ�⣬��ˮ�ⷴӦ�����ӷ���ʽΪ
���㣺�����ʱ�Ķ����жϼ��й�ph�ļ���
ר�⣺
��������1������Ϊǿ�ᣬ��������Ϊǿ��������Ϊ1��10��Ϻ���Һ�����ԣ���1��10-a=10��10b-14��
��2��������һԪ���ᣬ���Դ����Ũ��ԶԶ����������Ũ�ȣ�������ͼ�Ũ�ȴ�Сȷ����Һ�����С��
��3���������������Ӻͼ������������ӵĹ�ϵ��ϻ����Һ�������ȷ�����ǿ�����Ӷ�ȷ����ˮ������ӣ�����ˮ�ⷽ��ʽд�����ɣ�
��2��������һԪ���ᣬ���Դ����Ũ��ԶԶ����������Ũ�ȣ�������ͼ�Ũ�ȴ�Сȷ����Һ�����С��
��3���������������Ӻͼ������������ӵĹ�ϵ��ϻ����Һ�������ȷ�����ǿ�����Ӷ�ȷ����ˮ������ӣ�����ˮ�ⷽ��ʽд�����ɣ�
���
�⣺��1������Ϊǿ�ᣬ��������Ϊǿ��������Ϊ1��10��Ϻ���Һ�����ԣ���1��10-a=10��10b-14�����a+b=13���ʴ�Ϊ��13��
��2��������������ʣ����Դ�����Һ��c��H+��=10-a mol/L��c��CH3COOH��������������Һ��c��OH-��=10 b-14 mol/L����a+b=14��c��H+��=10-a mol/L=c��OH-��=10 b-14 mol/L��c��CH3COOH����Ҫʹ��Ϻ����Һ�����ԣ�����Ҫ�������Ƶ�������ڴ���������ʴ�Ϊ������
��3������c��H+��=10-a mol/L������c��OH-��=10 b-14 mol/L��a+b=14������c��H+��=10-a mol/L=c��OH-��=10 b-14 mol/L�����ߵ������Ϻ���Һ�Լ��ԣ�˵���������������������Ũ��С�ڼ�Ũ�ȣ����Ըü��������Һ��ˮ��������Ǹü�������ӣ�ˮ�ⷽ��ʽΪM++H2O?MOH+H+��
�ʴ�Ϊ��M++H2O?MOH+H+��
��2��������������ʣ����Դ�����Һ��c��H+��=10-a mol/L��c��CH3COOH��������������Һ��c��OH-��=10 b-14 mol/L����a+b=14��c��H+��=10-a mol/L=c��OH-��=10 b-14 mol/L��c��CH3COOH����Ҫʹ��Ϻ����Һ�����ԣ�����Ҫ�������Ƶ�������ڴ���������ʴ�Ϊ������
��3������c��H+��=10-a mol/L������c��OH-��=10 b-14 mol/L��a+b=14������c��H+��=10-a mol/L=c��OH-��=10 b-14 mol/L�����ߵ������Ϻ���Һ�Լ��ԣ�˵���������������������Ũ��С�ڼ�Ũ�ȣ����Ըü��������Һ��ˮ��������Ǹü�������ӣ�ˮ�ⷽ��ʽΪM++H2O?MOH+H+��
�ʴ�Ϊ��M++H2O?MOH+H+��
���������⿼���������Һ��pH�ļ��㣬Ϊ��Ƶ���㣬ע���¶ȡ�ˮ�����ӻ�������Ũ����pH�Ļ���Ϊ���Ĺؼ������ط�������������Ŀ��飬��Ŀ�ѶȲ���

��ϰ��ϵ�д�
�����Ŀ
ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�NaCl��NaClO��NaClO3�Ļ��Һ�����ⶨNaClO��NaClO3�����ʵ���֮��Ϊ1��3����Cl2��NaOH��Һ��Ӧʱ����ԭ����Ԫ���뱻��������Ԫ�ص����ʵ���֮��Ϊ��������
| A��3��11 | B��11��3 |
| C��1��4 | D��4��1 |
���������ĸ�ͼ���˵������ȷ���ǣ������� 

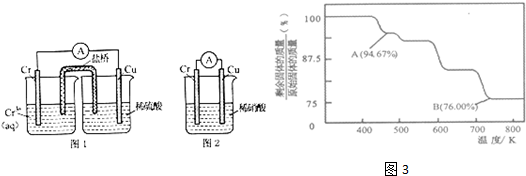
| A��ͼ��t1ʱ�ı�������������������¶Ȼ�������ѹǿ |
| B��ͼ�ڸ�����Ϊ18O2-����Ϊ16O2- |
| C��ͼ����AΪCaO����B����ΪMgO |
| D��ͼ���еġ�H1����H2 |
����˵������ȷ���ǣ�������
| A����⾫��ͭʱ���Դ�ͭ����������ͭ������ |
| B����������������������� |
| C��Na2O2��ˮ������Ӧʱ��Na2O2����������ˮ����ԭ�� |
| D�����г��ּ�������Ҫ�ǵ绯ѧ��ʴ |
һ���¶��£���ӦN2��g��+3H2��g��?2NH3��g���ﵽ��ѧƽ��״̬�ı�־�ǣ�������
| A��N2��H2��NH3�����ʵ����������ٸı� |
| B��c��N2����c��H2����c��NH3��=1��3��2 |
| C����λʱ��ÿ����1molN2��ͬʱ����2mol NH3 |
| D��N2��H2�����ʵ���֮����NH3��2�� |
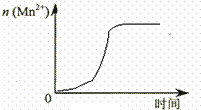 ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺
ij��ѧС��Ϊ���о���������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����������ʵ�飺