题目内容
下列说法中正确的是( )
| A、电解精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、金属氧化物均为碱性氧化物 |
| C、Na2O2与水发生反应时,Na2O2作氧化剂,水作还原剂 |
| D、自行车钢架生锈主要是电化学腐蚀 |
考点:电解原理,酸、碱、盐、氧化物的概念及其相互联系,金属的电化学腐蚀与防护,钠的重要化合物
专题:
分析:A.电解精炼铜时,粗铜作阳极,纯铜作阴极;
B.金属氧化物可能为酸性、碱性、两性氧化物;
C.Na2O2自身发生氧化还原反应;
D.铁与碳、潮湿的空气组成原电池,铁发生电化学腐蚀.
B.金属氧化物可能为酸性、碱性、两性氧化物;
C.Na2O2自身发生氧化还原反应;
D.铁与碳、潮湿的空气组成原电池,铁发生电化学腐蚀.
解答:
解:A.电解精炼铜时,粗铜作阳极,纯铜作阴极,在阴极上析出铜,粗铜中的杂质进入电解液而分离,故A错误;
B.Al2O3为两性氧化物,Mn2O7为酸性氧化物,故B错误;
C.过氧化钠和水的反应为:2Na2O2+2H2O=4NaOH+O2,化合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从-1价降为-2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故C错误;
D.铁与碳、潮湿的空气组成原电池,铁发生电化学腐蚀,所以自行车钢架生锈主要是电化学腐蚀所致,故D正确.
故选D.
B.Al2O3为两性氧化物,Mn2O7为酸性氧化物,故B错误;
C.过氧化钠和水的反应为:2Na2O2+2H2O=4NaOH+O2,化合价变化的只有过氧化钠中的氧元素,过氧化钠中的氧元素从-1价降为-2价,同时升为0价,所以Na2O2既是氧化剂又是还原剂,故C错误;
D.铁与碳、潮湿的空气组成原电池,铁发生电化学腐蚀,所以自行车钢架生锈主要是电化学腐蚀所致,故D正确.
故选D.
点评:本题考查较为综合,涉及氧化还原反应、氧化物的分类、电解原理及电化学腐蚀等知识,侧重于学生的基础知识的理解和运用的考查,难度不大,注意相关基础知识的积累.

练习册系列答案
相关题目
某500mL溶液中含0.2molFe2+、0.4molFe3+,加入0.4molFe,待反应完全后,溶液中亚铁离子的物质的量浓度为( )
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
对已达到化学平衡的反应:2SO2(g)+O2(g)?2SO3(g)△H<0,说法正确的是( )
| A、升高温度,正、逆反应速率都增大,平衡向逆方向移动 |
| B、减少压强,逆反应速率增大,正反应速率减少,平衡向逆方向移动 |
| C、移去部分SO3,正反应速率增大,逆反应速率减少,平衡向正方向移动 |
| D、加入催化剂,正、逆反应速率都增大,平衡常数不变 |
在10L密闭容器中,1mol A和3mol B在一定条件下反应:A(g)+xB(g)?2C(g),2min后达到平衡,生成0.4mol C,测得混合气体共3.4mol,则下列结果正确的是( )
| A、平衡时,物质的量之比n(A):n(B):n(C)=2:11:4 |
| B、x值等于3 |
| C、A的转化率为20% |
| D、B的平均反应速率为0.4 mol/(L?min) |
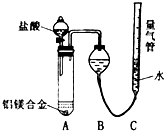 铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.
铝镁合金已成为轮船制造、化工生产等行业的重要材料.研究性学习小组的三位同学,为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计下列两种不同实验方案进行探究.请填写下列空白.