题目内容
1.食盐是日常生活的必需品,也是重要的化工原料.(1)粗盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,检验其中是否含有SO42-的实验操作是(叙述操作、现象结论)加入硝酸钡溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,证明硫酸根离子存在
(2)实验室提纯NaCl的流程如下:

提供的试剂:a.饱和Na2CO3溶液 b.饱和K2CO3溶液 c.NaOH溶液d.BaCl2溶液 e.Ba(NO3)2溶液 f.75%乙醇 g.盐酸
①欲除去上述溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为cda或dca(填序号);
②上述过滤操作选用下列提纯装置中的A(填A、B、C、D);

上述蒸发操作选用下列提纯装置中的C(填A、B、C、D)
③滤液中滴加盐酸调PH=4-5的目的是除掉过量的OH-、CO32-;
④上图中仪器的名称是b.漏斗 c.玻璃棒 d.分液漏斗e蒸发皿f蒸馏烧瓶
⑤用D装置蒸馏海水制取蒸馏水,冷却水应该从下进上出(填上、下)
分析 (1)硫酸根离子能与钡离子结合生成硫酸钡沉淀,硫酸钡为难溶于硝酸的白色沉淀,据此分析解答;
(2)实验室提纯NaCl的流程:粗盐中含有泥沙,故应该先加热溶解然后再过滤而得到澄清溶液I,除去钙离子选用碳酸钠溶液、除去镁离子选用氢氧化钠溶液、除去硫酸根离子选用氯化钡溶液,为了保证将杂质除尽,所加试剂必须过量,为了不引进新的杂质,应该先加入氢氧化钠或氯化钡,然后再加入碳酸钠,最后加入盐酸;滴加顺序依次为cda或dca,过滤,沉淀为碳酸钡、氢氧化镁,滤液主要为氯化钠和碳酸钠、氢氧化钠,加适量盐酸,从而除掉过量的OH-、CO32-,溶液Ⅱ中溶质为NaCl、KCl,蒸发浓缩得到糊状物,结晶(剩余少量液体停止加热),冷却过滤得到晶体,除去钾离子,烘干得到NaCl.
①把杂质转化为沉淀或气体除去,除钙离子用碳酸根离子,除镁离子、铁离子用氢氧根离子,除硫酸根离子用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
②过滤一般是用来分离不溶性固体和液体的混合物,蒸发实现溶质和溶剂的分离,结合各装置图所用的仪器分析判断;
③加适量盐酸可以除掉过量的OH-、CO32-;
④根据仪器的特点以及常见仪器的名称分析;
⑤蒸馏时,冷却水从冷凝管的下口通入,上口流出,可使冷凝管充满冷水而进行充分冷却.
解答 解:(1)含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,排除SO32-、CO32-和Ag+存在,硫酸根离子能与钡离子结合生成硫酸钡沉淀,所以检验粗盐中硫酸根离子的方法为:取少量溶液于试管中,加入硝酸钡溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则证明溶液中有SO42-,
故答案为:加入硝酸钡溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,证明硫酸根离子存在;
(2)①除去粗盐中的可溶性杂质:Ca2+、Mg2+、Fe3+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,按滴加顺序依次为cda或dca,
故答案为:cda或dca;
②粗盐提纯的步骤为:把含有泥沙的粗盐完全溶解;过滤除去不溶于水的泥沙,实现固液分离,需用漏斗、烧杯、铁架台,所以选择装置A,蒸发掉水分,即得到食盐晶体蒸发时,需要使用蒸发皿;需要铁架台和铁圈支撑蒸发皿;需要玻璃棒进行搅拌,以防止液体受热不均匀,造成液体飞溅;需要酒精灯进行加热;坩埚钳用于夹持蒸发皿,所以装置C符合,
故答案为:A;C;
③加适量盐酸,可以少引入杂质,并且盐酸与过量NaOH溶液和过量Na2CO3溶液发生反应,离子方程式为:H++OH-═H2O,CO32-+2H+═H2O+CO2↑,从而除掉过量的OH-、CO32-;
故答案为:除掉过量的OH-、CO32-;
④上图中仪器b具有球形特征的为漏斗、c为用于引流的玻璃棒、d带有玻璃活塞的分液漏斗、e为蒸发用的蒸发皿、f带有支管的为蒸馏烧瓶,
故答案为:漏斗;玻璃棒;分液漏斗;蒸发皿;蒸馏烧瓶;
⑤冷凝管中的水采用逆流方法,冷却水从冷凝管的下口通入,上口流出,可使冷凝管充满冷水而进行充分冷却,
故答案为:下;上.
点评 本题主要考查了粗盐提纯实验,为高频考查点,侧重于学生的分析和实验能力的考查,综合性强,要注意除杂质选取和添加的先后顺序,注意相关基础知识的积累,题目难度中等.

| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
(1)物质的量浓度均为0.1mol•L-1的四种溶液;
a.CH3COONa b.Na2CO3c.NaClO d.NaHCO3
pH由小到大排列的顺序是a<d<c<b(用编号填写).
(2)常温下,0.1mol•L-1CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是BD.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$ C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$ E.$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$
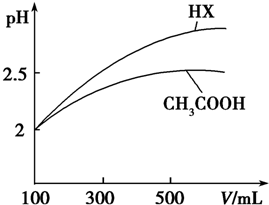
(3)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数大于(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数,理由是稀释相同倍数,一元酸HX的pH变化比CH3COOH的大,故HX酸性较强,电离平衡常数较大.
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得pH=6,则溶液中c(CH3COO-)-c(Na+)=9.9×10-7mol•L-1(填精确值).
(5)标准状况下,将1.12L CO2通入100mL 1mol•L-1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式:
①c (OH-)=2c(H2CO3)+c(HCO3-)+c(H+);②c(H+)+c(Na+)=c(HCO3-)+c(CO32-)+c(OH-).
| A. | 盐酸、水煤气、醋酸、干冰 | B. | 液氯、氯水、硫酸钠、乙醇 | ||
| C. | 空气、天然气、苛性钾、硫酸钡 | D. | 胆矾、漂白粉、氯化钾、氯气 |
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
对象,通过实验来比较不同物质的羟基中氢原子的活泼性.
某同学设计并实施了如下实验方案,请完成有关填空.
| 编号 | 实验操作 | 实验现象 | 结论及解释 |
| 1 | 分别取3种溶液,滴加紫色石蕊溶液 | 溶液会变红的是①③ | |
| 2 | 用足量的乙酸溶液浸泡碳酸钙 | 有关反应的化学方程式为CaCO3+2CH3COOH=Ca(CH3COO)2+H2O+CO2↑ | |
| 3 | 将CO2通入苯酚钠溶液中 | 有关反应的离子方程式为C6H5O-+CO2+H2O→C6H5OH+NHCO3- | |
| 结论:3种物质的羟基中的氢原子的活泼性由强到弱的顺序是③①②(填序号) | |||
 →
→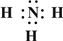 ,B的结构式为
,B的结构式为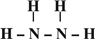 .
.