题目内容
3.欲配制450mL 0.5mol/LKOH溶液,试回答下列问题:(1)选择仪器.完成本实验所必需的仪器有托盘天平(最小的砝码为1g)、药匙、烧杯、玻璃棒、胶头滴管、500mL容量瓶等.
(3)称量.用托盘天平称量所需的KOH固体于烧杯中,若药品与砝码放反,则所称最KOH固体的质量不变(填“偏大”“偏小”或“不变”).
(4)溶解、冷却.该步实验中需要使用玻璃棒,其作用是搅拌,加速溶解.
(5)转移、洗涤.溶液转移后要洗涤烧杯2~3 次,其目的是保证溶质全部转移至容量瓶中.
(6)定容、摇匀.定容的操作是向容量瓶中加入蒸馏水至距刻度线1~2cm时,改用胶头滴管滴加蒸溜水至液体的凹液面和刻度线相切.
(7)某同学实际配制KOH溶液的浓度为0.48mol/L,原因可能是CD(填字母).
A.砝码已锈蚀,且铁锈不掉落
B.容最瓶中原来存有少量蒸馏水
C.转移时有溶液溅出
D.定容时仰视刻度线.
分析 (1)根据配制一定物质的量浓度溶液用到仪器进行解答;
(3)配制450mL 0.5mol/LKOH溶液,应选择500mL容量瓶,依据m=CVM计算需要溶质的质量;结合托盘天平使用称量原理解答;
(4)溶解固体时需要用玻璃棒搅拌加速固体溶解;
(5)依据实验原理C=$\frac{n}{V}$可知,为保证实验成功,应保证所以溶质均转移到容量瓶;
(6)依据定容的正确操作解答;
(7)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液用的仪器有:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制450mL 0.5mol/LKOH溶液,应选择500mL容量瓶,所以还缺少的仪器:胶头滴管、500mL容量瓶;
故答案为:胶头滴管、500mL容量瓶;
(3)配制450mL 0.5mol/LKOH溶液,应选择500mL容量瓶,需要溶质的质量m=0.5L×0.5mol/L×56g/mol=14.0g,最小的砝码为1g,不需要使用游码,所以若药品与砝码放反,质量不变,
故答案为:不变;
(4)溶解固体时需要用玻璃棒搅拌加速固体溶解;
故答案为:搅拌,加速溶解;
(5)依据实验原理C=$\frac{n}{V}$可知,为保证实验成功,应保证所以溶质均转移到容量瓶,所以转移、洗涤.溶液转移后要洗涤烧杯2~3 次,其目的是保证溶质全部转移至容量瓶中;
故答案为:保证溶质全部转移至容量瓶中;
(6)定容的操作是向容量瓶中加入蒸馏水至距刻度线1~2cm时,改用胶头滴管滴加蒸溜水至液体的凹液面和刻度线相切;
故答案为:向容量瓶中加入蒸馏水至距刻度线1~2cm时,改用胶头滴管滴加蒸溜水至液体的凹液面和刻度线相切;
(7)A.砝码已锈蚀,且铁锈不掉落,导致称量的溶质偏多,溶质的物质的量偏大,溶液浓度偏高,故不选;
B.容最瓶中原来存有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故不选;
C.转移时有溶液溅出,导致部分溶质损耗,溶质的物质的量偏小,溶液 浓度偏低,故C选;
D.定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故D选;
故选:CD.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和过程是解题关键,注意误差分析的方法和技巧,题目难度不大.

 如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )
如图所示,一悬挂的铜球浸没在稀硫酸溶液中,且铜球不与烧杯接触,现往稀硫酸中投入一铁片,待铁片充分反应后,铜球所受的拉力变化情况是( )| A. | 变大 | B. | 变小 | C. | 不变 | D. | 无法判断 |
| A. | 0.005mol | B. | 0.01mol | C. | 0.015mol | D. | 0.02mol |
| A. | 7.8gNa2O2中含有的阴离子数是0.2NA | |
| B. | 常温常压下,8gO2含有的电子数是4NA | |
| C. | 标准状况下,2.24LCCl4中含有分子数为0.1NA | |
| D. | 1L1.0mol•L-1Na2CO3溶液中含有的氧原子数为3NA |
| A. | 3,3-二甲基丁烷 | B. | 2,3-二甲基-4-乙基己烷 | ||
| C. | 2,3,3-三甲基丁烷 | D. | 2,2-二甲基-3-乙基丁烷 |
 →
→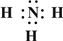 ,B的结构式为
,B的结构式为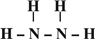 .
.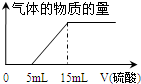 某化学兴趣小组用100mL 1mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化).为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验.请帮助他们完成下列相应实验内容.
某化学兴趣小组用100mL 1mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化).为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验.请帮助他们完成下列相应实验内容.