题目内容
8.水杨酸、冬青油、阿司匹林的结构简式如图,下列说法不正确的是( )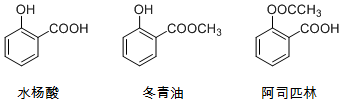
| A. | 由水杨酸制冬青油的反应是取代反应 | |
| B. | 阿司匹林的分子式为C9H8O4,水解可得水杨酸 | |
| C. | 冬青油苯环上的一氯取代物有4种 | |
| D. | 可用NaOH溶液除去冬青油中少量的水杨酸 |
分析 A.水杨酸发生酯化反应生成冬青油;
B.阿司匹林含有酯基,可水解生成水杨酸;
C.冬青油苯环不对称,含有4种H;
D.二者都与氢氧化钠溶液反应.
解答 解:A.由水杨酸制冬青油,可与乙酸酐发生取代反应制得,故A正确;
B.阿司匹林的分子式为C9H8O4,含有酯基,可水解生成水杨酸,故B正确;
C.冬青油苯环不对称,含有4种H,则一氯取代物有4种,故C正确;
D.二者都与氢氧化钠溶液反应,应用碳酸氢钠除杂,故D错误.
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.以熔融Na2CO3为电解质,H2和CO混合气为燃料的电池原理如图所示.下列说法正确的是( )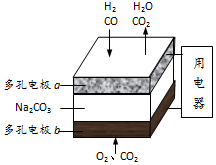

| A. | b是电池的负极 | |
| B. | a电极的反应为:CO+CO32ˉ-2eˉ═2CO2,H2+CO32ˉ-2eˉ═H2O+CO2 | |
| C. | a电极上每消耗22.4L原料气,电池中转移电子数约为2×6.02×1023 | |
| D. | a、b两极消耗的气体的物质的量之比是1:1 |
3.根据下列实验操作和现象得出的结论不合理的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将乙醇加入酸性重铬酸钾(K2Cr2O7)溶液中 | 橙色溶液变为绿色 | 乙醇具有还原性 |
| B | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 溶液变为蓝色 | 金属铁比铜活泼 |
| C | 将光亮的镁条放入NH4Cl溶液中 | 有大量气泡产生 | 反应生成H2和NH3 |
| D | 将NaAlO2溶液加入NaHCO3溶液中 | 有白色沉淀生成 | AlO2-结合H+的能力比HCO3-强 |
| A. | A | B. | B | C. | C | D. | D |
13.下列有关说法正确的是( )
| A. | 铁与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,则单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 过程的自发性只能用于判断其方向性,不能确定其是否一定会发生和发生的速率 | |
| D. | 中和反应放热说明中和反应前后能量不守恒 |
20.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.下图是工业上用制作印刷电路银板的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:(已知:滤液①和滤液②中溶质相同)

根据以上信息回答下列问题:
(1)写出生产过程中加入的试剂的名称:X铁粉,Y稀盐酸.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
析出CuCl晶体最佳pH为2,当pH较大时CuCl产率变低的原因是pH较大时,Cu2+水解程度增大,反应生成CuCl减少,产率减小.
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).

根据以上信息回答下列问题:
(1)写出生产过程中加入的试剂的名称:X铁粉,Y稀盐酸.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由:Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.
(4)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是防止CuCl的氧化和见光分解,减少产品CuCl的损失.
(5)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率 | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(6)氯化亚铜的定量分析:
①称取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈[Ce(SO4)2]标准溶液滴定.
已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下
| 平行实验次数 | 1 | 2 | 3 | 4 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 25.35 | 24.05 | 23.95 | 24.00 |
4.对NO2与水的反应中下列说法中正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:2 | |
| C. | 反应中若有6molNO2参与反应,有4mol电子转移 | |
| D. | 反应中NO2是氧化剂,水是还原剂 |
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O