题目内容
4.对NO2与水的反应中下列说法中正确的是( )| A. | 氧化剂与还原剂的物质的量之比为2:1 | |
| B. | 氧化产物与还原产物的物质的量之比为1:2 | |
| C. | 反应中若有6molNO2参与反应,有4mol电子转移 | |
| D. | 反应中NO2是氧化剂,水是还原剂 |
分析 该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂,硝酸是氧化产物,NO是还原产物,根据二氧化氮和转移电子之间的关系式计算转移电子的物质的量.
解答 解:A.该反应中N元素的化合价由+4价变为+5价和+2价,所以生成硝酸的二氧化氮是还原剂,其计量数是2,生成NO的二氧化氮是氧化剂,其计量数是1,所以氧化剂和还原剂的物质的量、质量之比都是1:2,故A错误;
B.由A分析可知,氧化剂与还原剂的物质的量比为2:1,故B错误;
C.在反应中有3molNO2反应,有2mol电子发生转移,反应中若有6molNO2参与反应,有4mol电子转移,故C正确;
D.该反应中N元素的化合价由+4价变为+5价和+2价,所以二氧化氮既是氧化剂又是还原剂,水中各元素都不变,所以既不是氧化剂又不是还原剂,故D错误;
故选C.
点评 本题考查氧化还原反应,明确元素化合价是解本题关键,注意该反应中化合价变化的元素只有N元素,为易错点,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
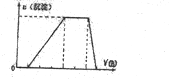
7.下列有关图示与对应的叙述正确的是( )
| A. |  图纵坐标为元素的最高正价 | |
| B. |  图可说明反应2NO+2CO=N2+2CO2为吸热反应 | |
| C. | 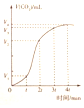 若图表示的是一定量的CaCO3与盐酸反应生成CO2的体积随时间的变化,则t~2tmin反应速率最快 | |
| D. | 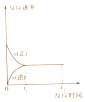 若图表示的是反应N2(g)+3H2(g)?2NH3(g)的.v(正)、v(逆)随时间的变化,则0~t1时间段:v(正)=v(逆) |
8.水杨酸、冬青油、阿司匹林的结构简式如图,下列说法不正确的是( )
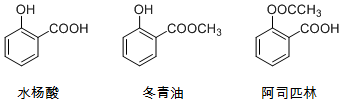

| A. | 由水杨酸制冬青油的反应是取代反应 | |
| B. | 阿司匹林的分子式为C9H8O4,水解可得水杨酸 | |
| C. | 冬青油苯环上的一氯取代物有4种 | |
| D. | 可用NaOH溶液除去冬青油中少量的水杨酸 |
9.如图,四种装置中所盛的溶液体积均为500mL,浓度均为0.6molL-1,(③可以实现铁表面镀锌)工作一段时间后,测得导线上均通过了0.2mol电子,此时溶液中的pH由大到小的顺序是( )

| A. | ④②①③ | B. | ④③①② | C. | ④③②① | D. | ①③②④ |
16.ClO2是一种杀菌消毒效率高、二次污染小的水处理剂.实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$2ClO2↑+K2SO4+2CO2+2H2O↑.下列有关该反应的说法正确的是( )
| A. | H2C2O4是氧化剂 | |
| B. | KClO3是还原剂 | |
| C. | H2C2O4在反应中被氧化 | |
| D. | 1molKClO3参加反应有2mol电子转移 |
8.下列关于有机化合物的说法正确的是( )
| A. | 乙烯能够使溴水褪色,是因为乙烯和溴水反应生成了2-溴乙烷 | |
| B. | 将红热的铜丝插入到1-丙醇中,可以制得丙酮 | |
| C. | 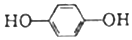 和苯酚互为同系物 和苯酚互为同系物 | |
| D. | 分子式为C10H12具有两个邻位链烃取代基的芳香烃有4种(不考虑立体异构) |
 已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属.
已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属. .
.