题目内容
18.电化学原理常应用于工农业生产、对工业废水和生活污水进行处理.(1)对工业废水进行处理是防止水体污染、改善水质的主要措施之一,含氰废水中的CN-有剧毒.
①CN-中碳元素显+2价,则非金属性N>C(填<,=或>)
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$ 2HCO3-+2NH3.
(2)某研究性学习小组模拟工业生产,将下列装置如图1连接,C、D、E、X、Y 都是石墨,F是铁,丙是模拟精炼铜.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答下列问题:
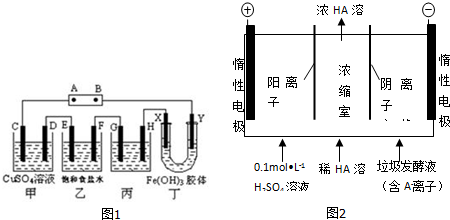
①电源 B 极的名称是负极
②甲装置中电解反应的总化学方程式是:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4 _.
③通电一段时间后,丙中原电解质的物质的量浓度将变小(填“变大”、“变小”或“不变”).
④装置丁中的现象是Y极附近溶液颜色变深.
(3)对生活污水进行处理是防止水体污染、改善水质的主要措施.电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图2所示(图中“HA”表示乳酸分子,A-表示乳酸根离子).阳极的电极反应式为Y极附近溶液颜色变深.
②电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计.400mL 10g•L-1乳酸溶液通电一段时间后,浓度上升为145g•L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为6.72L.(乳酸的摩尔质量为90g•mol-1)
分析 (1)①同周期元素从左至右核电荷数逐渐增多,原子半径逐渐减小非金属性增强;
②CN-能够被氧气氧化成HCO3-,同时生成NH3,根据所给反应物和生成物判断应有水参与;
(2)①电解饱和食盐水时,阴极电极反应2H++2e-=H2↑,H+放电破坏了水的电离平衡,使溶液中的c(OH-)>c(H+),溶液呈碱性,使酚酞呈红色,所以F极为阴极,据此回答;
②电解硫酸铜生成氧气和硫酸、铜;
③精炼铜时,粗铜作阳极,粗铜有杂质,其中有的杂质比Cu先失电子;
④胶体有电泳现象,Fe(OH)3胶体中胶粒带正电;
(3)在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=0.5n(乳酸),据此计算.
解答 解:(1)①C和N同周期,C在N的左边.同周期元素从左至右核电荷数逐渐增多,原子半径逐渐减小,核对最外层电子的引力逐渐减弱,非金属性N>C;故答案为:>;
②CN-能够被氧气氧化成HCO3-,同时生成NH3,根据所给反应物和生成物判断应有水参与,该反应的离子方程式为2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$ 2HCO3-+2NH3;故答案为:2CN-+4H2O+O2$\frac{\underline{\;微生物\;}}{\;}$ 2HCO3-+2NH3;
(2)①电解饱和食盐水时,阴极电极反应2H++2e-=H2↑,H+放电破坏了水的电离平衡,使溶液中的c(OH-)>c(H+),溶液呈碱性,使酚酞呈红色,所以F极为阴极,对应的外电源B极为负极,A极为正极;故答案为:负极;
②电解硫酸铜生成氧气和硫酸、铜,即总反应:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4;
③精炼铜时,粗铜作阳极,粗铜有杂质,其中有的杂质比Cu先失电子,导致此时溶液中的Cu+浓度下降,等变成Cu失电子时,Cu2+浓度就不再变化了;④胶体有电泳现象,Fe(OH)3胶体中胶粒带正电,故胶粒向外电源负极B方向移动,即Y极附近红褐色变深.故答案为:变小;
④装置丁会发生胶体的电泳现象,氢氧化铁胶体中的胶粒带正点,会移向阴极,即Y极附近溶液颜色变深,故答案为:Y极附近溶液颜色变深;
(3)反应过程中产生的乳酸的质量是0.400 L(145g/L-10g/L)=54g.则乳酸的物质的量是$\frac{54g}{90g/mol}$=0.6mol;因为在反应过程乳酸根离子结合的H+离子的个数与反应过程中放电的H+或OH-的个数相等,所以n(H2)=$\frac{1}{2}$n(乳酸)=0.3mol,其在标准状况下体积是0.3mol×22.4L/mol=6.72L,故答案为:6.72.
点评 本题考查学生电解池的工作原理自己电极反应式的书写和反应现象的判断知识,注意知识的迁移应用是关键,难度中等.

 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案
下列说法正确的是( )
| 窗口编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
 |  | H2(g) | ||
| 1 | 380 | 0.10 | 0.60 | 0.060 |
| 2 | 380 | 0.20 | ||
| 3 | 230 | 0.10 | 0.050 | 0.050 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器I中的H2体积分数比容器Ⅱ中的小 | |
| C. | 容器I中反应达到平衡所需的时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅲ中充入0.10mol (g)、0.10mol (g)、0.10mol (g)和0.10mol H2,则反应向逆反应方向进行 (g)和0.10mol H2,则反应向逆反应方向进行 |
| A. | x+y<z | B. | 平衡向正反应方向移动 | ||
| C. | A的体积分数下降 | D. | B的浓度增大 |
| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |

 .
.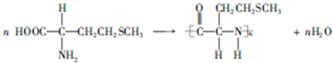 .
. .
.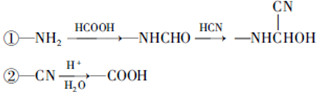
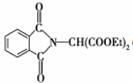
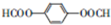
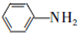 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物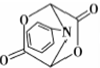 的流程如下:
的流程如下: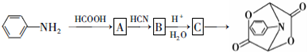
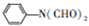 ,C
,C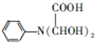 .
.