题目内容
8.下列粒子半径之比大于1的是( )| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
分析 A.同种元素的阳离子半径小于原子半径;
B.同主族自上而下原子半径增大;
C.电子层一样,质子数越小,半径越大;
D.同种元素的阴离子半径大于原子半径.
解答 解:A.同种元素的阳离子半径小于原子半径,则二者比值小于1,故A不符合;
B.Mg、Ca同主族,自上而下原子半径增大,半径之比小于1,故B不符合;
C.氧离子和钠离子电子层一样,但是氧原子质子数少,所以半径大,二者半径比值大于1,故C符合;
D.同种元素的阴离子半径大于原子半径,则二者半径之比小于1,故D不符合,
故选C.
点评 本题考查微粒半径的比较,明确原子半径的比较方法、离子半径与原子半径的关系即可解答,题目难度不大

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
16.葡萄糖酸钙是一种可促进骨骼生长的营养物质.葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
实验流程如下:
C2H12O6溶液$\stackrel{滴加3%溴水/55℃}{→}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{赵热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:B.
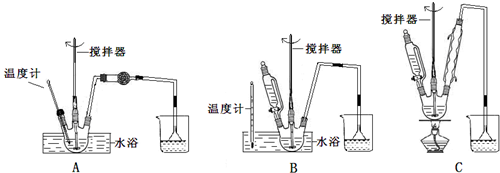
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH 溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙,且易引入杂质,不易分离.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是降低葡萄糖酸钙溶解度,使其结晶析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C2H12O6溶液$\stackrel{滴加3%溴水/55℃}{→}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{赵热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:B.

制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH 溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙,且易引入杂质,不易分离.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是降低葡萄糖酸钙溶解度,使其结晶析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.
3.下列有关电化学的图示,完全正确的是( )
| A. | 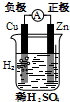 Cu-Zn原电池 | B. | 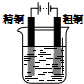 CuSO4溶液粗铜的精炼 | ||
| C. |  NnCl2溶液铁片镀锌 | D. |  饱和NaCl溶液验证气体产物 |
13.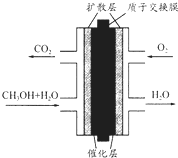 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )| A. | 通入O2的电极反应式为:O2+4e-+2H2O═4OH- | |
| B. | 电池内部H+由正极渗过交换膜向负极移动 | |
| C. | 甲醇在正极发生反应,电流经过外电路流向负极 | |
| D. | 注入CH3OH的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ |
18.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | Na202与足量H20反应生成标况下11.2L 02.转移电子的数目为2NA | |
| B. | 标准状况下,2.24L S03中所含电子数为4NA | |
| C. | 用惰性电极电解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| D. | 0℃和101kp的条件下,1.12L甲烷完全燃烧生成的水分子数为0.1NA |
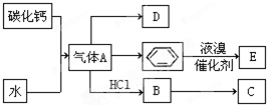
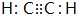 ;D的最简式CH2=CH2;
;D的最简式CH2=CH2;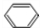 +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$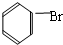 +HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$
+HBr,其反应类型为取代反应.B→C的化学方程式nCH2=CHCl$\stackrel{催化剂}{→}$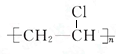 ,其反应类型为加聚反应.
,其反应类型为加聚反应.