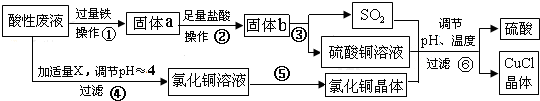
题目内容
7.蛋氨酸片适用于脂肪肝以及酒精和磺胺等药物引起的肝损害.其组分蛋氨酸的合成路线如下:
说明:流程图中“Et”为乙基.
(1)C的结构简式为
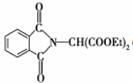 .
.(2)D→E的反应类型为水解反应(或取代反应).
(3)由E合成F时生成了另一种有机物G,G的化学名称为邻苯二甲酸;由蛋氨酸合成多肽的化学方程式为
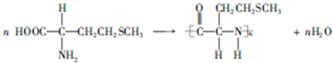 .
.(4)H与G互为同分异构体.H能发生银镜反应,且苯环上的一氯代物只有1种,水解后的产物能与FeCl3溶液发生显色反应.写出满足上述条件的H的结构简式:
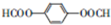 .
.(5)已知:
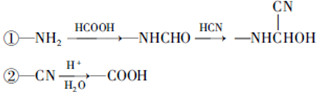
以
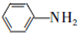 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物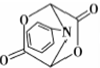 的流程如下:
的流程如下: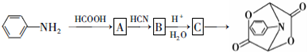
写出上述流程图方框中相应有机物的结构简式:A
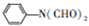 ,C
,C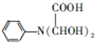 .
.
分析 (1)比较B和D的结构简式可知,B与BrCH(COOC2H5)2发生取代反应生成C为 ;
;
(2)比较D和E的结构简式可知,D中有肽键和酯基在氢氧化钠溶液中发生水解反应生成E;
(3)比较E和F的结构利用元素守恒可知,G为 ,由蛋氨酸合成多肽时,蛋氨酸中的羧基和氨基之间脱水,发生缩聚反应生成多肽,据此书写化学方程式;
,由蛋氨酸合成多肽时,蛋氨酸中的羧基和氨基之间脱水,发生缩聚反应生成多肽,据此书写化学方程式;
(4)H与G互为同分异构体,H能发生银镜反应,说明有醛基,苯环上的一氯代物只有1种,说明苯环上的基团分布较对称,水解后的产物能与FeCl3溶液发生显色反应,说明水解后有酚羟基,根据G的结构可书写H的结构;
(5)以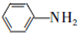 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物 时,用
时,用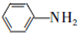 与HCOOH发生信息①中的反应生成A为
与HCOOH发生信息①中的反应生成A为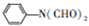 ,A与HCN发生信息①中的加成反应生成B为
,A与HCN发生信息①中的加成反应生成B为 ,B再在酸性条件下水解得C为
,B再在酸性条件下水解得C为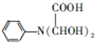 ,据此答题.
,据此答题.
解答 解:(1)比较B和D的结构简式可知,B与BrCH(COOC2H5)2发生取代反应生成C为 ,
,
故答案为: ;
;
(2)比较D和E的结构简式可知,D中有肽键和酯基在氢氧化钠溶液中发生水解反应(或取代反应)生成E,
故答案为:水解反应(或取代反应);
(3)比较E和F的结构利用元素守恒可知,G为 ,其名称为邻苯二甲酸,由蛋氨酸合成多肽时,蛋氨酸中的羧基和氨基之间脱水,发生缩聚反应生成多肽,反应的化学方程式为
,其名称为邻苯二甲酸,由蛋氨酸合成多肽时,蛋氨酸中的羧基和氨基之间脱水,发生缩聚反应生成多肽,反应的化学方程式为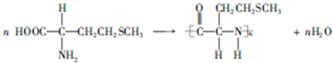 ,
,
故答案为:邻苯二甲酸;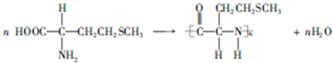 ;
;
(4)H与G互为同分异构体,H能发生银镜反应,说明有醛基,苯环上的一氯代物只有1种,说明苯环上的基团分布较对称,水解后的产物能与FeCl3溶液发生显色反应,说明水解后有酚羟基,G的结构可知符合条件的H的结构为 ,
,
故答案为: ;
;
(5)以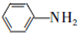 和HCOOH为原料制备化合物
和HCOOH为原料制备化合物 时,用
时,用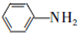 与HCOOH发生信息①中的反应生成A为
与HCOOH发生信息①中的反应生成A为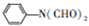 ,A与HCN发生信息①中的加成反应生成B为
,A与HCN发生信息①中的加成反应生成B为 ,B再在酸性条件下水解得C为
,B再在酸性条件下水解得C为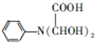 ,
,
故答案为: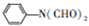 ;
;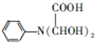 .
.
点评 本题考查有机物的合成,题目难度中等,正确理解流程及题中信息、把握有机物的官能团及其性质、有机反应类型等为解答的关键,明确合成流程中结构与官能团的变化,难点是同分异构体种类的判断.

| A. | Cl2 | B. | SO2 | C. | CO | D. | O2 |
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:(1)铝热反应实验:取磁性氧化铁粉按课本中的实验装置(如图)进行铝热反应,将反应
后所得“铁块”溶于盐酸,向反应后的溶液中滴加KSCN溶液,发现溶液变血红色.
①出现这种现象的原因,除了因“铁块”中可能混有没反应完的磁性氧化铁外,还有一种可能原因是熔融的铁被空气中氧气氧化.
②若要证明反应所得“铁块”中含有金属铝,可用(填化学式)溶液,所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)化学反应速率影响因素的探究实验:
KI在经酸化的溶液中被空气氧化的反应式为:4H++4I-+O2=2I2+2H2O.该反应的速率受温度、酸度、溶剂、试剂浓度等影响,可用淀粉与碘的显色反应来观测该反应的速率.已知,淀粉与碘的显色反应在温度升高时灵敏度会降低,高于75℃则不能显色;淀粉浓度越高显色越灵敏、颜色也越深.
实验小组拟用0.8mol•L-1 KI溶液、0.1mol•L-1H2SO4溶液、淀粉溶液等来探究温度、酸度对上述反应速率的影响,他们做了A-C三组实验,部分实验数据如下表:
| 编号 | 温度/℃ | H2SO4体积/mL | KI溶液体积/mL | H2O体积/mL | 淀粉溶液 /mL | 出现蓝色时间/s |
| A | 39 | 10 | 5 | 5 | 1 | 5 |
| B | TB | 10 | 5 | 5 | 1 | 没出现蓝色 |
| C | 5 | 10 | 5 | 5 | 1 | 39 |
| D | t |
②A-C三组实验时,都加入了5mL水,其目的是为了在后续研究酸度因素对反应速率影响时保持KI和淀粉浓度不变.
③B组实验中“没出现蓝色”,原因是温度(TB)高于75℃,淀粉与碘不显色.
④请你为小组设计D组实验方案(在表格空白处填入你设计的5个数据),以帮助小组完成探究目标.
⑤按你设计的实验数据,请你预测一个t值,并写出与你预测相对应的探究实验结论.
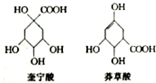 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为4:5 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2↑
相关物质的溶解性见下表:
| 物质名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 | 氯化钙 |
| 水中的溶解性 | 可溶于冷水、易溶于热水 | 可溶 | 易溶 | 易溶 |
| 乙醇中的溶解性 | 微溶 | 微溶 | 可溶 | 可溶 |
C2H12O6溶液$\stackrel{滴加3%溴水/55℃}{→}$$→_{②}^{过量CaCO_{3}/70℃}$$→_{③}^{赵热过滤}$$→_{④}^{乙醇}$悬浊液$→_{⑤}^{抽滤}$$→_{⑥}^{洗涤}$$→_{⑦}^{干燥}$Ca(C6H11O7)2
请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最适合的是:B.
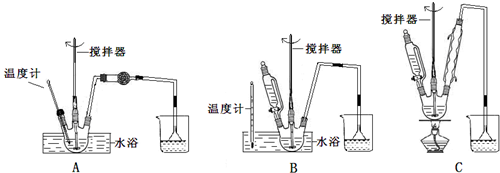
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是C.
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH 溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是提高葡萄糖酸的转化率;本实验中不宜用CaCl2替代CaCO3,理由是氯化钙难以与葡萄糖酸直接反应得到葡萄糖酸钙,且易引入杂质,不易分离.
(3)第③步需趁热过滤,其原因是葡萄糖酸钙冷却后会结晶析出,如不趁热过滤会损失产品.
(4)第④步加入乙醇的作用是降低葡萄糖酸钙溶解度,使其结晶析出.
(5)第⑥步中,下列洗涤剂最合适的是D.
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液.