题目内容
3.在一定温度下,向饱和烧碱溶液中放入一定量的Na2O2,完合反应恢复到原温度,下列说法正确的是( )| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
分析 过氧化钠与水反应生成NaOH和O2,消耗水,溶液有NaOH晶体析出,反应后仍为饱和溶,结合饱和溶液的特点解答该题.
解答 解:过氧化钠与水反应生成NaOH和O2,消耗水,溶液有NaOH晶体析出,反应后仍为饱和溶液,浓度不变,pH不变,则A、B错误,由于溶剂的质量减少,则饱和溶液中的溶质的物质的量减小,Na+数目减少,故CD正确.
故选CD.
点评 本题考查钠的重要化合物,侧重于化学知识的综合应用的考查,注意把握饱和溶液的性质,学习中注意相关基础知识的积累,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
13.今有120mL0.20mol/L Na2CO3的溶液和某浓度的200mL盐酸,不管将前者滴入后者,还是将后者滴入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A. | 1.5 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
14.已知VmL的Fe2(SO4)3溶液中含SO42-ag,取0.25VmL该溶液稀释至4VmL,则稀释后的溶液中Fe3+的物质的量浓度为( )
| A. | $\frac{125a}{288V}$mol•L-1 | B. | $\frac{125a}{72V}$mol•L-1 | ||
| C. | $\frac{a}{2304V}$mol•L-1 | D. | 以上答案均不正确 |
11.下列有关化学用语表示正确的是( )
| A. | 甲酸甲酯的结构简式:CH2O | |
| B. | Na+的.结构示意图: | |
| C. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | CO2的电子式为: |
8.已知:常温下浓度为0.1mol•L-1的下列溶液的pH如表:
下列有关说法正确的是( )
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
15.下列气体不能用排空气法收集的是( )
| A. | Cl2 | B. | SO2 | C. | CO | D. | O2 |
12.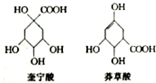 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为4:5 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
13.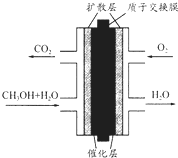 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )| A. | 通入O2的电极反应式为:O2+4e-+2H2O═4OH- | |
| B. | 电池内部H+由正极渗过交换膜向负极移动 | |
| C. | 甲醇在正极发生反应,电流经过外电路流向负极 | |
| D. | 注入CH3OH的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ |