题目内容
8.钛是继铁、铝后的第三金属,二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料.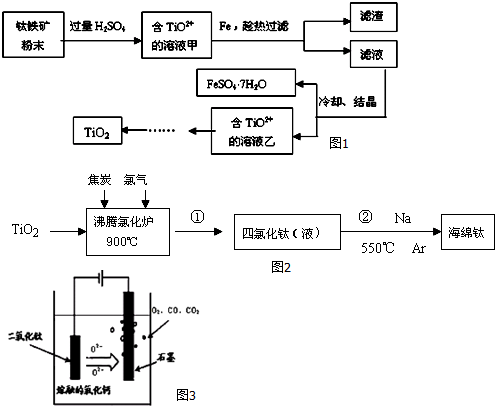
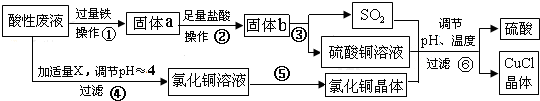
Ⅰ.用钛铁矿制取二氧化钛,(钛铁矿主要成分为FeTiO3,其中Ti元素化合价为+4价,含有Fe2O3杂质.)主要流程如图1:
(1)Fe2O3与H2SO4反应的离子方程式Fe2O3+6H+=2Fe3++3H2O.
(2)加Fe的作用是将Fe3+还原为Fe2+.
Ⅱ.由金红石(含TiO2大于96%)为原料生产钛的流程如图2:
(3)反应②的方程式是TiCl4+4Na$\frac{\underline{\;550℃\;}}{氩气}$4NaCl+Ti,该反应需要在Ar气氛中进行的原因是防止高温下Na(Ti)与空气中的O2(或N2、CO2)作用.
Ⅲ.科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺.
(4)TiO2直接电解法生产钛是一种较先进的方法,电解质为熔融的氧化钙,原理如图3所示 该方法阴极获得钛的电极反应为TiO2+4e-=Ti+2O2-.
(5)阳极产生的CO2经常用氢氧化钠溶液来吸收,现有0.4mol CO2用200ml 3mol/L的NaOH溶液将其完全吸收,溶液中的离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析 I.钛铁矿用硫酸溶解,得到溶液中含有TiO2+、Fe2+、Fe3+,加入Fe粉将Fe3+还原为Fe2+,过滤除去不溶物,滤液冷却结晶析出硫酸亚铁晶体,过滤分离,滤液中经过系列转化得到TiO2;
(1)Fe2O3与H2SO4反应生成硫酸铁与水;
(2)加入Fe粉将Fe3+还原为Fe2+;
Ⅱ.(3)在550℃时、氩气环境下,Na与四氯化钛发生置换反应;高温时,Na、Ti易与空气中的氧气等发生反应;
Ⅲ.TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子;根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠来分析回答.
解答 解:I.钛铁矿用硫酸溶解,得到溶液中含有TiO2+、Fe2+、Fe3+,加入Fe粉将Fe3+还原为Fe2+,过滤除去不溶物,滤液冷却结晶析出硫酸亚铁晶体,过滤分离,滤液中经过系列转化得到TiO2;
(1)Fe2O3与H2SO4反应生成硫酸铁与水,反应离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故答案为:Fe2O3+6H+=2Fe3++3H2O;
(2)加Fe的作用是:将Fe3+还原为Fe2+,故答案为:将Fe3+还原为Fe2+;
Ⅱ.(3)在550℃时、氩气环境下,Na与四氯化钛发生置换反应,反应方程式为:TiCl4+4Na$\frac{\underline{\;550℃\;}}{氩气}$4NaCl+Ti,高温时,Na、Ti易与空气中的氧气等发生反应,所以该反应需要在Ar气氛中进行,
故答案为:TiCl4+4Na$\frac{\underline{\;550℃\;}}{氩气}$4NaCl+Ti;防止高温下Na(Ti)与空气中的O2(或N2、CO2)作用;
Ⅲ.(4)TiO2直接电解法生产钛,发生还原反应,二氧化钛为阴极,连接电源负极,由示意图可知二氧化钛获得电子生成Ti与氧离子,阴极电极反应式为:TiO2+4e-=Ti+2O2-,
故答案为:TiO2+4e-=Ti+2O2-;
III.(4)电解时,阴极上得电子发生还原反应,所以二氧化钛得电子生成钛和氧离子,和电源负极相连,电极反应式为TiO2+4e-=Ti+2O2-;
故答案为:TiO2+4e-=Ti+2O2-;
(5)根据二氧化碳和氢氧化钠之间反应量的关系:按照1:1反应,产物是碳酸氢钠,按照1:2反应,产物是碳酸钠,0.4molCO2和200mL 3mol/L NaOH溶液混合,二者的物质的量之比是2:3,所的溶液是碳酸钠和碳酸氢钠的混合物,混合物显碱性c(OH-)>c(H+),碳酸根离子水解程度大与碳酸氢根离子的水解程度,所以c(CO32-)<c(HCO3-),即c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
点评 本题以金属的冶炼为载体,考查化学工艺流程、电解原理、离子浓度大小比较、信息获取等问题,有利于培养学生分析解决问题能力、信息获取与知识移运用,难度中等.

 阅读快车系列答案
阅读快车系列答案| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
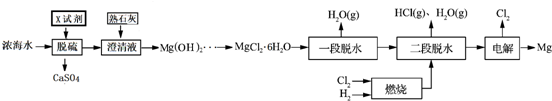
请回答下列问题
(1)浓海水主要含有的四种离子中质量浓度最小的是Mg2+.在上述流程中,可以循环使用的物质是Cl2、HCl.
(2)在该工艺过程中,X试剂的化学式为CaCl2.
(3)“一段脱水”目的是制备MgCl2•2H2O;“二段脱水”的目的是制备电解原料.若将MgCl2•6H2O直接加热脱水,则会生成Mg(OH)Cl.若电解原料中含有Mg(OH)Cl,电解时Mg(OH)Cl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率.生成MgO的化学方程式为2Mg(OH)Cl+Mg=MgCl2+2MgO+H2↑.
(4)若制得Mg(OH)2的过程中浓海水的利用率为80%,由Mg(OH)2至“二段脱水”制得电解原料的过程中镁元素的利用率为90%,则1m3浓海水可得“二段脱水”后的电解原料质量为84672g.
(5)以LiCl-KCl共熔盐为电解质的Mg-V2O5电池是战术导弹的常用电源,该电池的总反应为:Mg+V2O5+2LiCl═MgCl2+V2O4•Li2O 该电池的正极反应式为V2O5+2Li++2e-=V2O4•Li2O.
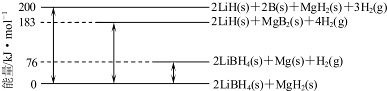
(6)Mg合金是重要的储氢材料.2LiBH4/MgH2体系放氢焓变示意图如下,则:
Mg(s)+2B(s)═MgB2(s)△H=-93 kJ•mol-1.
| A. | 紫色、红色 | B. | 红色、蓝色 | C. | 蓝色、红色 | D. | 红色、无色 |
| A. | 1.5 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
| A. | 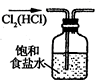 除去Cl2中HCl | B. | 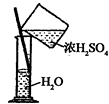 稀释浓H2SO4 | C. | 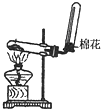 制取氧气 | D. | 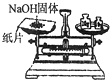 称取NaOH |
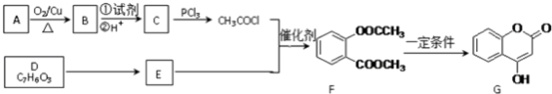
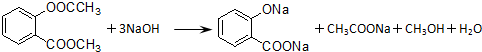 .
.
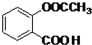 .
.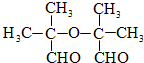 .
.