题目内容
2.恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g)+3H2(g)?2NH3(g)(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值为:16.
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%.计算平衡时NH3的物质的量为:8mol.
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始):n(平)=5:4.
(4)原混合气体中,a:b=2:3.
(5)平衡混合气体中,n(N2):n(H2):n(NH3)=3:3:2.
分析 (1)某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,结合反应可知转化的氮气为6mol×$\frac{1}{2}$=3mol,a=nt(N2)+n转化(N2);
(2)气体的总物质的量为$\frac{716.8L}{22.4LL/mol}$=32mol,NH3的含量(体积分数)为25%,平衡时n(NH3)=32mol×25%=8mol;
N2 (g)+3H2(g)?2NH3(g)
开始 16 b 0
转化 4 12 8
平衡 12 b-12 8
12+b-12+8=32,解得b=24,以此解答(3)~(5).
解答 解:(1)某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,结合反应可知转化的氮气为6mol×$\frac{1}{2}$=3mol,a=nt(N2)+n转化(N2)=16mol,
故答案为:16;
(2)平衡时气体的总物质的量为$\frac{716.8L}{22.4LL/mol}$=32mol,NH3的含量(体积分数)为25%,平衡时n(NH3)=32mol×25%=8mol,
故答案为:8mol;
N2 (g)+3H2(g)?2NH3(g)
开始 16 b 0
转化 4 12 8
平衡 12 b-12 8
12+b-12+8=32,解得b=24,
(3)n(始):n(平)=(16+24):32=5:4,故答案为:5:4;
(4)原混合气体中,a:b=16:24=2:3,故答案为:2:3;
(5)平衡混合气体中,n(N2):n(H2):n(NH3)=12:12:8=3:3:2,故答案为:3:3:2.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、体积比等于物质的量比等为解答的关键,侧重分析与计算能力的考查,注意b的确定方法,题目难度不大.

| A. | 升高温度 | B. | 降低压强 | C. | 及时分离出Z | D. | 使用催化剂 |
 Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
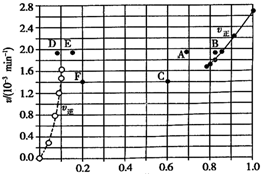
| A. | 若升高温度到某一温度,则再次达到平衡时,相应点 可能分別是A、E | |
| B. | 若再次充人a molHI,则达到平衡时,相应点的播坐 标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,则再次达到平衡时,相应 点与改变条件前相间 | |
| D. | 若改变的条件是使用催化剂.则再次达到平衡时,相 应点与改变条件前不间. |
| A. | 先加NaOH,后加Na2CO3,再加BaCl2 | B. | 先加NaOH,后加BaCl2,再加Na2CO3 | ||
| C. | 先加Na2CO3,后加BaCl2,再加NaOH | D. | 以上答案皆可 |
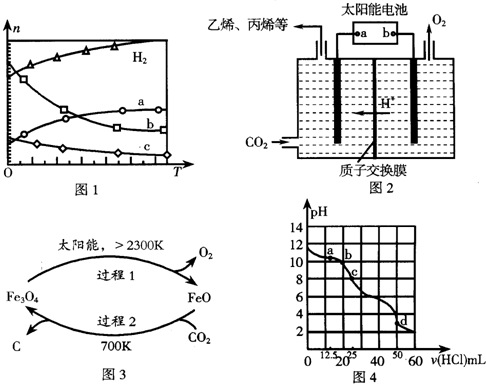
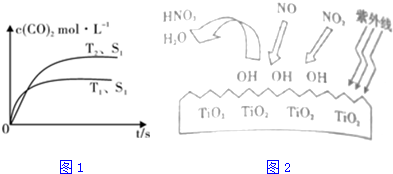
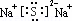
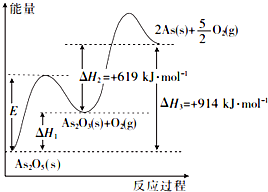 砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题:
砷的常见酸性氧化物有As2O3和As2O5,根据图中信息回答下列问题: