题目内容
7.W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素.(1)W、X各自的最高价氧化物对应的水化物可以反应生盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
(2)W与Y 可形成化合物W2Y,该化合物的电子式为
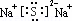
(3)X的硝酸盐水溶液显酸性,用离子方程式解释原因Al3++3H2O═Al(OH)3+3H+
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为SO2+C12+2H2O═H2SO4+2HCl
(5)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ•mol-1
(6)写出质子数比中子数少3的Z元素的核素符号3717Cl
(7)写出W的最高价氧化物的水化物中的化学键离子键、极性共价键(填写完整化学键类型)
分析 (1)W、X是金属元素,W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W为Na,X为Al;
(2)W与Y可形成化合物W2Y,则Y是非金属硫,该化合物为硫化钠;
(3)硝酸铝为强酸弱碱盐,铝离子部分水解,溶液显酸性;
(4)Y、Z是非金属元素,Y的低价氧化物通入Z单质的水溶液中,则Z为Cl,二氧化硫和氯气反应生成盐酸与硫酸;
(5)Z的最高价氧化物为无色液体,为Cl2O7,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量,则1molCl2O7与水反应放出4DkJ的热量;
(6)Z为Cl,质子数数为17,质子数比中子数少3,则中子数为20,质量数为37;
(7)W为Na,对应的最高价氧化物的水化物为NaOH.
解答 解:(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,则W是金属钠,X是金属铝,氢氧化铝是两性氢氧化物,能和强碱反应生成盐和水,该反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
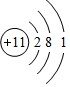
(2)W与Y可形成化合物W2Y,则Y是非金属硫,硫化钠使钠离子和硫离子间通过离子键形成的离子化合物,电子式为: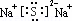 ,
,
故答案为: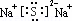 ;
;
(3)X为Al,其硝酸盐为硝酸铝,铝离子在溶液中部分水解:Al3++3H2O═Al(OH)3+3H+,溶液显示酸性,
故答案为:酸;Al3++3H2O═Al(OH)3+3H+;
(4)Y、Z是非金属元素,Y的低价氧化物通入Z单质的水溶液中,则Z为Cl,二氧化硫和氯气反应生成盐酸与硫酸,该反应为:SO2+C12+2H2O═H2SO4+2HCl,
故答案为:SO2+C12+2H2O═H2SO4+2HCl;
(5)Z的最高价氧化物C12O7为无色液体,0.25mol该物质与一定量水混合得到HClO4的水化物的稀溶液,并放出Q kJ的热量,则1mol Cl2O7反应放出的热量为4QkJ,故该反应的热化学方程式为:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ•mol-1,
故答案为:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ•mol-1;
(6)Z为Cl,质子数数为17,质子数比中子数少3,则中子数为20,质量数为37,可表示为3717Cl,故答案为:3717Cl;
(7)W为Na,对应的最高价氧化物的水化物为NaOH,含有离子键、极性共价键,故答案为:离子键、极性共价键.
点评 本题考查位置、结构、性质的关系的综合应用,题目难度中等,熟悉第三周期元素的性质变化规律及常见元素的单质和化合物的性质是解答本题的关键,试题培养了学生灵活应用基础知识解决实际问题的能力.

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案| 单质 | A | B | C | D | E |
| 最高价氧化物 对应水化物的稳定性 | 难分解 | 能分解 | 能分解 | 能分解 | 能分解 |
| 单质性质 | 与水剧烈反应 | 缓慢溶于热水 | 溶于强碱性溶液 | 难溶于冷的浓硝酸 | 溶于浓、稀硝酸 |
根据要求,回答下列问题:
(1)C元素最高价氧化物对应的水化物既能与酸反应,又能与碱反应,原因分别是:Al(OH)3?Al3++3OH-;Al(OH)3?H++AlO2-+H2O(用电离方程式表示)
(2)以B、C为电极,A的氢氧化物的水溶液为电解质溶液,构成原电池.写出C极的电极反应式:Al-3e-+4OH-=AlO2-+2H2O.
(3)用离子方程式表示D的单质能与D的化合物在水溶液中发生化合反应:Fe+2Fe3+=3Fe2+.
(4)E的单质在加热条件下能与浓硫酸反应,其反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+H2O.
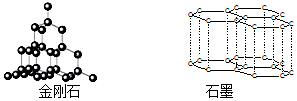
| A. | 根据:C(金刚石,s)+O2(g)═CO2(g)△H=-395.41 kJ•mol-1C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1说明金刚石比石墨稳定,石墨转变为金刚石为放热反应 | |
| B. | 相同质量的金刚石与石墨晶体中,所含共价键数相同 | |
| C. | 估计金刚石与石墨的熔沸点均较高,硬度均较大 | |
| D. | 现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
 .
.