题目内容
10.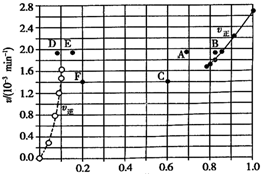 Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:
Bodensteins 研究了反应+I2(g)?H2(g)+I2(g)△H=+11kL•mol-1在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如表:| l/min | 0 | 20 | 40 | 60 | 80 | 120 |
| x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
| A. | 若升高温度到某一温度,则再次达到平衡时,相应点 可能分別是A、E | |
| B. | 若再次充人a molHI,则达到平衡时,相应点的播坐 标值不变,纵坐标值增大 | |
| C. | 若改变的条件是增大压强,则再次达到平衡时,相应 点与改变条件前相间 | |
| D. | 若改变的条件是使用催化剂.则再次达到平衡时,相 应点与改变条件前不间. |
分析 A.升高温度,正、逆反应速率均加快,正反应为吸热反应,升高温度,平衡向吸热反应方向移动;
B.反应前后气体体积不变,恒容容器中若再次充入a mol HI,相当于增大压强,平衡不变;
C.改变压强改变反应速率缩短达到平衡时间,平衡不变;
D.使用催化剂不能使化学平衡发生移动;
解答 解:A.对于2HI(g)?H2(g)+I2(g)反应建立平衡时:升高温度,正、逆反应速率均加快,因此排除C点,正反应为吸热反应,升高温度,平衡向吸热反应方向移动,因此平衡正向移动,再次平衡时HI的物质的量分数减小,因此排除B点,故选A点;
对于H2(g)+I2(g)?2HI(g)反应建立平衡时:
升高温度,正、逆反应速率均加快,升高温度,平衡向吸热反应方向移动,因此平衡逆向移动,再次平衡时H2的物质的量分数增大,故选E点;
因此反应重新达到平衡,v正~x(HI)对应的点为A,v逆~x(H2)对应的点为E,故A正确;
B.反应前后气体体积不变,恒容容器中若再次充入a mol HI,相当于增大压强,平衡不变,则达到平衡时,相应点的横坐标值不变,纵坐标值增大,故B正确;
C.若改变的条件是增大压强,再次达到平衡时,平衡不变,但反应时间缩短,纵轴数值改变,相应点与改变条件前不相同,故C错误;
D.若改变的条件是使用催化剂,再次达到平衡时,催化剂改变反应速率,不改变化学平衡,相应时间点与改变条件前不同,故D正确;
故选:C.
点评 本题考查了化学平衡移动的影响因素,准确把握图象含义,熟悉化学平衡移动的原理是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列化学用语书写正确的是( )
| A. | 氯原子的结构示意图: | B. | 氯化镁的电子式: | ||
| C. | N2的电子式: | D. | 氯化氢分子的形成过程: |
20.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O═H2SO4+2HI
2FeCl2+Cl2═2FeCl3
2FeCl3+2HI═2FeCl2+2HCl+I2.
I2+SO2+2H2O═H2SO4+2HI
2FeCl2+Cl2═2FeCl3
2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | SO2>I->Fe2+ | B. | I->Fe2+>SO2 | C. | Fe2+>I->SO2 | D. | Fe2+>SO2>I- |
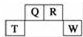 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题: .
.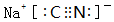 .
.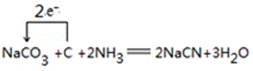 .
. .
.