题目内容
X、Y、Z、W、R是元素周期表前四周期中的常见元素,其相关信息如下表:
(1)W在元素周期表中的位置为 ; X、Z、W三种元素的原子半径从大到小的顺序是 (用元素符号表示).
(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为 ;B的结构式为 ;化合物ZY中存在的化学键类型为 .
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为 ,其最高价氧化物的化学式为 .该族2~4周期元素的气态氢化物的稳定性从大到小的顺序是 (用化学式表示).
(4)用RCl3溶液腐蚀铜线路板的离子方程式为 .检验溶液中R3+常用的试剂是 ,可以观察到的现象是 .
| 元素 | 相关信息 |
| X | 组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2 |
| Y | 地壳中含量最高的元素 |
| Z | 存在质量数为23,中子数为11的核素 |
| W | 生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质 |
| R | 有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
(2)X与氢两元素按原子数目比1:3和2:4构成分子A和B,A的电子式为
(3)砷(As)是人体必需的微量元素,与X同一主族,As原子比X原子多两个电子层,则砷的原子序数为
(4)用RCl3溶液腐蚀铜线路板的离子方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:X是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则X为N元素;
Y是地壳中含量最高的元素,则Y是O元素;
Z存在质量数为23,中子数为11的核素,Z的质子数是12,为Mg元素;
W是生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质,则R是Al元素;
R有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则R是Fe元素.
Y是地壳中含量最高的元素,则Y是O元素;
Z存在质量数为23,中子数为11的核素,Z的质子数是12,为Mg元素;
W是生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质,则R是Al元素;
R有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则R是Fe元素.
解答:
解:X是组成蛋白质的基础元素,其最高正化合价与最低负化合价的代数和为2,则X为N元素;
Y是地壳中含量最高的元素,则Y是O元素;
Z存在质量数为23,中子数为11的核素,Z的质子数是12,为Mg元素;
W是生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质,则R是Al元素;
R有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则R是Fe元素.
(1)Al在元素周期表中的位置为第三周期第ⅢA族,电子层数越多原子半径越大,同一周期中,原子半径随着原子序数的增大而减小,所以N、Mg、Al四种元素的原子半径从大到小的顺序是Mg>Al>N,
故答案为:第3周期第 IIIA族;Mg>Al>N;
(2)N与氢两元素按原子数目比1:3和2:4构成分子A和B,A和B分别是NH3、N2H4,A的电子式为 ,B的结构式为
,B的结构式为  ,化合物MgO中存在的化学键类型为离子键,
,化合物MgO中存在的化学键类型为离子键,
故答案为: ;
; ; 离子键;
; 离子键;
(3)砷(As)是人体必需的微量元素,与N元素同一主族,As原子比N原子多两个电子层,则砷的原子序数为7++8+18=33,砷的最高化合价为+5价,所以其最高价氧化物的化学式为As2O5,同一主族元素中,随着原子序数的增大其气态氢化物的稳定性逐渐减小,所以该族2~4周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3 ,故答案为:33;As2O5;NH3>PH3>AsH3;
(4)FeCl3溶液腐蚀铜线路板的离子方程式为2Fe3++Cu=Cu2++2Fe2+,检验溶液中Fe3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色,
故答案为:Cu+2Fe3+═Cu2++2Fe2+;KSCN溶液;溶液呈红色.
Y是地壳中含量最高的元素,则Y是O元素;
Z存在质量数为23,中子数为11的核素,Z的质子数是12,为Mg元素;
W是生活中大量使用其合金制品,工业上可用电解熔融氧化物的方法制备其单质,则R是Al元素;
R有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色,则R是Fe元素.
(1)Al在元素周期表中的位置为第三周期第ⅢA族,电子层数越多原子半径越大,同一周期中,原子半径随着原子序数的增大而减小,所以N、Mg、Al四种元素的原子半径从大到小的顺序是Mg>Al>N,
故答案为:第3周期第 IIIA族;Mg>Al>N;
(2)N与氢两元素按原子数目比1:3和2:4构成分子A和B,A和B分别是NH3、N2H4,A的电子式为
 ,B的结构式为
,B的结构式为  ,化合物MgO中存在的化学键类型为离子键,
,化合物MgO中存在的化学键类型为离子键,故答案为:
 ;
; ; 离子键;
; 离子键;(3)砷(As)是人体必需的微量元素,与N元素同一主族,As原子比N原子多两个电子层,则砷的原子序数为7++8+18=33,砷的最高化合价为+5价,所以其最高价氧化物的化学式为As2O5,同一主族元素中,随着原子序数的增大其气态氢化物的稳定性逐渐减小,所以该族2~4周期元素的气态氢化物的稳定性从大到小的顺序是NH3>PH3>AsH3 ,故答案为:33;As2O5;NH3>PH3>AsH3;
(4)FeCl3溶液腐蚀铜线路板的离子方程式为2Fe3++Cu=Cu2++2Fe2+,检验溶液中Fe3+常用的试剂是KSCN溶液,可以观察到的现象是溶液呈红色,
故答案为:Cu+2Fe3+═Cu2++2Fe2+;KSCN溶液;溶液呈红色.
点评:本题考查较为综合,涉及结构性质与位置关系、常用化学用语、元素周期律等,为高频考点,侧重于学生的分析能力的考查,难度中等,推断元素是关键.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
下列有关蒸馏的实验装置与操作的说法中不正确的是( )
| A、蒸馏烧瓶必须垫石棉网加热 |
| B、蒸馏烧瓶中应加入碎瓷片,防止出现暴沸现象 |
| C、蒸馏是利用物质溶解性的差异将物质加以分离的操作 |
| D、冷凝管中的水流是从下口进入,上口排出 |
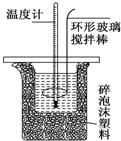 测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.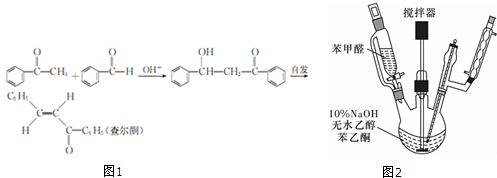
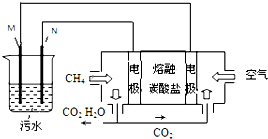 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.