题目内容
氢能是最重要的新能源.储氢作为氢能利用的关键技术,是当前关注的热点之一.
(1)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为 .
(2)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.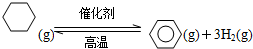
某温度下,向恒容容器中加入环已烷,其起始浓度为amol?L-1,平衡时苯的浓度为bmol?L-1,该反应的平衡常数K=
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物).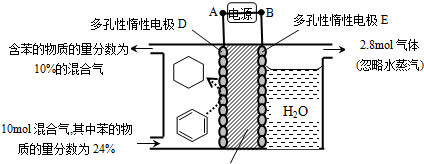
①导线中电子转移方向为 .(用A、D表示)
②生成目标产物的电极反应式为 .
③该储氢装置的电流效率η= .(η=生成目标产物消耗的电子数/转移的电子总数×100%,计算结果保留小数点后1位.)
(1)NaBH4是一种重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为
(2)储氢还可借助有机物,如利用环已烷和苯之间的可逆反应来实现脱氢和加氢.

某温度下,向恒容容器中加入环已烷,其起始浓度为amol?L-1,平衡时苯的浓度为bmol?L-1,该反应的平衡常数K=
(3)一定条件下,如图所示装置可实现有机物的电化学储氢(忽略其它有机物).

①导线中电子转移方向为
②生成目标产物的电极反应式为
③该储氢装置的电流效率η=
考点:电解原理,化学方程式的书写,化学平衡常数的含义
专题:
分析:(1)NaBH4与水反应生成NaBO2,且反应前后B的化合价不变,H元素化合价由-1价、+1价变为0价,结合转移电子守恒配平方程式;
(2)依据化学平衡常数=生成物浓度幂之积与反应物浓度幂之积比值计算;
(3)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
③阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
(2)依据化学平衡常数=生成物浓度幂之积与反应物浓度幂之积比值计算;
(3)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是负极、B是正极,电子从负极流向阴极;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷;
③阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷,苯参加反应需要电子的物质的量与总转移电子的物质的量之比就是电流效率η.
解答:
解:(1)NaBH4与水发生氧化还原反应生成NaBO2和H2,化学方程式为:NaBH4+2H2O=NaBO2+4H2↑;
故答案为:NaBH4+2H2O=NaBO2+4H2↑;
(2)环己烷的起始浓度为amol?L-1,平衡时苯的浓度为bmol?L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,K=
=
=
(mol/L)3;
故答案为
(mol/L)3;
(3)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向阴极,所以电子从A流向D,
故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,
生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量=
×100%=10%;
x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,
×100%=64.3%;
故答案为:64.3%.
故答案为:NaBH4+2H2O=NaBO2+4H2↑;
(2)环己烷的起始浓度为amol?L-1,平衡时苯的浓度为bmol?L-1,同一容器中各物质反应的物质的量浓度之比等于其计量数之比,所以根据方程式知,环己烷的平衡浓度为(a-b)mol/L,氢气的浓度为3bmol/L,K=
| [C6H6][H2]3 |
| [C6H12] |
| b×(3b)3 |
| a-b |
| 27b4 |
| a-b |
故答案为
| 27b4 |
| a-b |
(3)①根据图知,苯中的碳得电子生成环己烷,则D作阴极,E作阳极,所以A是分解、B是正极,电子从负极流向阴极,所以电子从A流向D,
故答案为:A→D;
②该实验的目的是储氢,所以阴极上发生的反应为生产目标产物,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,
故答案为:C6H6+6H++6e-=C6H12;
③阳极上氢氧根离子放电生成氧气,阳极上生成2.8mol氧气转移电子的物质的量=2.8mol×4=11.2mol,
生成1mol氧气时生成2mol氢气,则生成2.8mol氧气时同时生成5.6mol氢气,
设参加反应的苯的物质的量是xmol,参加反应的氢气的物质的量是3xmol,剩余苯的物质的量为10mol×24%-xmol,反应后苯的含量=
| 10mol×24%-x |
| 10mol-3xmol+5.6mol |
x=1.2,苯转化为环己烷转移电子的物质的量为1.2mol×6=7.2mol,
| 7.2mol |
| 11.2mol |
故答案为:64.3%.
点评:本题考查了化学平衡、电解池原理等知识点,熟悉化学平衡常数表达式、电解池工作原理是解题关键,题目难度较大.

练习册系列答案
相关题目
咖喱是一种烹饪辅料,若白衬衣被咖喱汁玷污后,用普通的肥皂洗涤时,会发现黄色污渍变为红色,经水漂洗后红色又变黄色.据此现象,你认为咖喱汁与下列何种试剂可能有相似的化学作用( )
| A、品红溶液 | B、石蕊溶液 |
| C、氯水 | D、碘化钾-淀粉溶液 |
用下列装置进行相应实验,能达到实验目的是( )
| 选项 | A | B | C | D |
| 装置 |  |  |  |  |
| 目的 | 除去Cl2中含有的少量HCl | 蒸干NH4Cl饱和溶液制备NH4Cl晶体 | 制取少量CO2气体 | 分离CCl4萃取碘水后已分层的有机层和水层 |
| A、A | B、B | C、C | D、D |
实验室里进行过滤和蒸发操作都要用到的仪器是( )
| A、漏斗 | B、玻璃棒 |
| C、蒸发皿 | D、酒精灯 |
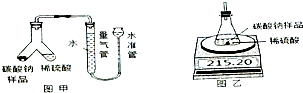 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质,为了测定该产品中碳酸钠的纯度,某化学研究性学习小组设计有关方案进行如图实验:
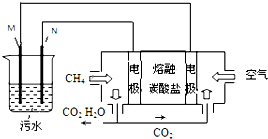 工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.
工业废水中常含有一定量的Cr2O72-,会对人类及生态系统产生很大损害,电解法是一种行之有效的除去铬的方法之一.该法用Fe和石墨作电极电解含Cr2O72-的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的.某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如图所示.