题目内容
A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数.A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是( )
| A、B元素原子的电子排布式为1S22S22P63S23P5 |
B、化合物AB的电子式为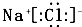 |
C、化合物AB的电子式为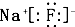 |
| D、A与水反应的离子方程式为Na+H2O═OH-+Na++H2 |
考点:原子结构与元素的性质,氧化还原反应
专题:氧化还原反应专题,原子组成与结构专题
分析:A、B两元素可形成AB型离子化合物,则A为+1价,B为-1价,A、B的单质均能与水发生剧烈反应,则B为F,AB的阴、阳离子具有相同的电子数,则B为Na,据此结合选分析.
解答:
解:A、B两元素可形成AB型离子化合物,则A为+1价,B为-1价,A、B的单质均能与水发生剧烈反应,则B为F,AB的阴、阳离子具有相同的电子数,则B为Na,
A、B为F元素,核外有9个电子,其电子排布式为1S22S22P5,故A错误;
B、化合物AB为NaF,则其电子式为: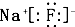 ,故B错误;
,故B错误;
C、化合物AB为NaF,则其电子式为: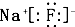 ,故C正确;
,故C正确;
D、Na与水反应生成氢氧化钠和氢气,其离子方程式为2Na+2H2O═2OH-+2Na++H2↑,故D错误.
故选C.
A、B为F元素,核外有9个电子,其电子排布式为1S22S22P5,故A错误;
B、化合物AB为NaF,则其电子式为:
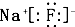 ,故B错误;
,故B错误;C、化合物AB为NaF,则其电子式为:
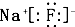 ,故C正确;
,故C正确;D、Na与水反应生成氢氧化钠和氢气,其离子方程式为2Na+2H2O═2OH-+2Na++H2↑,故D错误.
故选C.
点评:本题考查了元素的推断、电子排布式、电子式、离子方程式,题目难度不大,根据化合价及单质的性质推断元素是解题的关键.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、双原子分子中化学键键能越大,分子越牢固 |
| B、双原子分子中化学键键长越长,分子越牢固 |
| C、双原子分子中化学键键角越大,分子越牢固 |
| D、同一分子中,σ健与π健的分子轨道重叠程度一样多,只是重叠的方向不同 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、25℃,1.01×105 Pa,64g SO2中含有的原子数为3NA |
| B、在常温常压下,11.2L Cl2含有的分子数为0.5NA |
| C、含有NA个氩原子的氩气在标准状况下的体积约为11.2L |
| D、标准状况下,11.2L H2O2含有的分子数为0.5NA |
在标准状况下①6.72L CH4②3.01×1023个HCl分子③13.6g H2S ④0.2mol NH3,下列对这四种气体的关系从大到小表达不正确的是( )
| A、体积②>③>①>④ |
| B、密度②>③>④>① |
| C、质量②>③>①>④ |
| D、氢原子个数①>④>③>② |
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
| A、HCl |
| B、稀K2SO4溶液 |
| C、FeCl3 |
| D、稀NaOH溶液 |
将11.9g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下体积为3.36L.另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4g,则上述反应中生成NO气体的体积为(标准状况下)( )
| A、6.72 L |
| B、11.2 L |
| C、22.4 L |
| D、4.48 L |
 (1)下列实验操作或对实验事实的描述正确的有
(1)下列实验操作或对实验事实的描述正确的有