题目内容
将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
| A、HCl |
| B、稀K2SO4溶液 |
| C、FeCl3 |
| D、稀NaOH溶液 |
考点:钠的化学性质
专题:几种重要的金属及其化合物
分析:钠和水反应生成氢氧化钠和氢气,溶液质量减轻,说明从溶液中放出气体的质量大于溶液增加的质量.
解答:
解:A.钠和盐酸的反应方程式为:2Na+2HCl═2NaCl+H2↑,根据方程式知,溶液增加的质量=m(Na)-m(H2),故A错误;
B.钠与硫酸钾溶液的反应实质是钠与水的反应,钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,所以溶液质量增加,溶液增加的质量=m(Na)-m(H2),故B错误;
C.钠与氯化铁溶液反应生成氢气和氢氧化铁,反应的方程式为:6Na+2FeCl3+6H2O═6NaCl+2Fe(OH)3↓+3H2↑,根据方程式可知,溶液减少的质量=m(H2)+m(Fe(OH)3)-m(Na),故C正确;
D.钠与氢氧化钠溶液的反应实质是钠与水的反应,钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,所以溶液质量增加,溶液增加的质量=m(Na)-m(H2),故D错误;
故选:C.
B.钠与硫酸钾溶液的反应实质是钠与水的反应,钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,所以溶液质量增加,溶液增加的质量=m(Na)-m(H2),故B错误;
C.钠与氯化铁溶液反应生成氢气和氢氧化铁,反应的方程式为:6Na+2FeCl3+6H2O═6NaCl+2Fe(OH)3↓+3H2↑,根据方程式可知,溶液减少的质量=m(H2)+m(Fe(OH)3)-m(Na),故C正确;
D.钠与氢氧化钠溶液的反应实质是钠与水的反应,钠和水的反应方程式为:2Na+2H2O═2NaOH+H2↑,所以溶液质量增加,溶液增加的质量=m(Na)-m(H2),故D错误;
故选:C.
点评:本题考查了钠的性质,注意钠与盐溶液反应时,先与水反应,生成的氢氧化钠再与盐发生复分解反应,题目难度不大.

练习册系列答案
相关题目
在水溶液中能大量共存的一组离子或离子分子组是( )
| A、I2、SO32-、Cl-、Na+ |
| B、K+、Cu2+、OH-、NO3- |
| C、NH4+、Na+、Br-、SO42- |
| D、Ag+、NH3*H2O、NO3-、Na+ |
A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数.A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是( )
| A、B元素原子的电子排布式为1S22S22P63S23P5 |
B、化合物AB的电子式为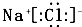 |
C、化合物AB的电子式为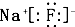 |
| D、A与水反应的离子方程式为Na+H2O═OH-+Na++H2 |
下列有关化学概念或原理的论述中,正确的是( )
| A、任何一个氧化还原反应都可以设计为电池,输出电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D、任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
下列物质属于纯净物的是( )
| A、液氧 | B、氯水 |
| C、漂白液 | D、碘酒. |
根据化学反应的实质是旧键断裂生成这一观点,下列变化不属于化学反应的是( )
| A、石墨转化为金刚石 |
| B、NaOH溶液与盐酸反应生成NaCl和H2O |
| C、NaCl熔化 |
| D、Na2O溶于水 |
 图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )
图中,“-”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙.下面四组选项中,符合图示要求的是( )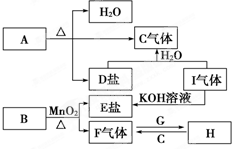 已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)
已知A、B、C、D、E、F、G、H、I九种物质,其中A、B、D、E焰色反应均为紫色(透过蓝色钴玻璃),G、F是单质,其余均为化合物,H是一种淡黄色固体,它们的转化关系如图所示.请回答:(提示:实验室制氧气可用氯酸钾与二氧化锰[作催化剂]混合加热制取)