题目内容
 (1)下列实验操作或对实验事实的描述正确的有
(1)下列实验操作或对实验事实的描述正确的有A.用托盘天平称量17.55g氯化钠晶体
B.碳酸钠溶液保存在带橡胶塞的试剂瓶
C.用干燥的pH试纸测定新制氯水的pH
D.使用容量瓶配制溶液时,俯视刻度线定容后浓度偏大
E.向饱和FeCl3溶液中滴加少量NaOH溶液,可制取Fe(OH)3胶体
F.用苯萃取溴水中的溴时,从分液漏斗下口放出将溴的苯溶液
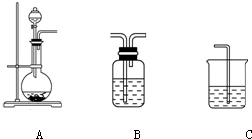
(2)如图为中学化学实验中常见的实验装置
①实验室常用装置A制备气体,请将分液漏斗和圆底烧瓶中应装的化学试剂的名称填写在下表中.
| 气体 | O2 | Cl2 | NH3 |
| 分液漏斗中试剂 | H2O | 浓氨水 | |
| 圆底烧瓶中试剂 | KMnO4 |
③C装置用于处理多余气体对环境的污染,若利用该装置吸收Cl2,此时烧杯中发生反应的离子方程式为
考点:化学实验方案的评价,实验装置综合
专题:实验评价题
分析:(1)A.托盘天平的感量是0.1g;
B.碳酸钠溶液保存在带橡胶塞的试剂瓶;
C.次氯酸具有漂白性;
D.使用容量瓶配制溶液时,俯视刻度线定容后溶液体积偏小,浓度偏大;
E.向饱和FeCl3溶液中滴加少量NaOH溶液,不可制取Fe(OH)3胶体,得到的是氢氧化铁沉淀;
F.苯的密度小于水,所以在水上方;
(2)①该装置属于固液混合不加热型装置,实验室可以用双氧水和二氧化锰制取氧气、用高锰酸钾和浓盐酸制取氯气、用浓氨水和碱石灰或氧化钙或氢氧化钠制取氨气;
②用排液法收集气体时,导气管遵循“短进长出”原则;实验室用排饱和食盐水的方法收集氯气;
③可以用NaOH溶液除去氯气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;氨气极易溶于水会产生倒吸现象;有缓冲装置的能防止倒吸.
B.碳酸钠溶液保存在带橡胶塞的试剂瓶;
C.次氯酸具有漂白性;
D.使用容量瓶配制溶液时,俯视刻度线定容后溶液体积偏小,浓度偏大;
E.向饱和FeCl3溶液中滴加少量NaOH溶液,不可制取Fe(OH)3胶体,得到的是氢氧化铁沉淀;
F.苯的密度小于水,所以在水上方;
(2)①该装置属于固液混合不加热型装置,实验室可以用双氧水和二氧化锰制取氧气、用高锰酸钾和浓盐酸制取氯气、用浓氨水和碱石灰或氧化钙或氢氧化钠制取氨气;
②用排液法收集气体时,导气管遵循“短进长出”原则;实验室用排饱和食盐水的方法收集氯气;
③可以用NaOH溶液除去氯气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水;氨气极易溶于水会产生倒吸现象;有缓冲装置的能防止倒吸.
解答:
解:(1)A.托盘天平的感量是0.1g,所以不能称量17.55g氯化钠晶体,故错误;
B.玻璃中含有二氧化硅,碳酸钠水解导致溶液呈碱性,二氧化硅和碱反应生成粘性的硅酸钠而使瓶塞粘结在一起,所以碳酸钠溶液保存在带橡胶塞的试剂瓶中,故正确;
C.氯水中含有次氯酸,次氯酸具有漂白性,所以不能用pH试纸测氯水pH值,故错误;
D.使用容量瓶配制溶液时,俯视刻度线定容后溶液体积偏小,浓度偏大,故正确;
E.向饱和FeCl3溶液中滴加少量NaOH溶液,不可制取Fe(OH)3胶体,得到的是氢氧化铁沉淀,向沸水中滴加几滴饱和氯化铁溶液再加热至沸腾得到氢氧化铁胶体,故错误;
F.苯的密度小于水,所以苯在上方、水在下方,从分液漏斗上口放出将溴的苯溶液,故错误;
故选BD;
(2)①该装置属于固液混合不加热型装置,实验室可以用双氧水和二氧化锰制取氧气、用高锰酸钾和浓盐酸制取氯气、用浓氨水和碱石灰或氧化钙或氢氧化钠制取氨气,故答案为:
②用排液法收集气体时,导气管遵循“短进长出”原则,所以气体应从该装置右管口导进;实验室用排饱和食盐水的方法收集氯气,故答案为:右;饱和食盐水;
③可以用NaOH溶液除去氯气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-═ClO-+Cl-+H2O;氨气极易溶于水会产生倒吸现象,所以不能用稀硫酸吸收氨气,有缓冲装置的能防止倒吸,四氯化碳密度大于水,如果将四氯化碳与水混合时,水在四氯化碳上方,该装置能起到缓冲作用,防止倒吸,
故答案为:Cl2+2OH-═ClO-+Cl-+H2O;氨气极易溶于水(稀硫酸);会引起倒吸;CCl4(或四氯化碳).
B.玻璃中含有二氧化硅,碳酸钠水解导致溶液呈碱性,二氧化硅和碱反应生成粘性的硅酸钠而使瓶塞粘结在一起,所以碳酸钠溶液保存在带橡胶塞的试剂瓶中,故正确;
C.氯水中含有次氯酸,次氯酸具有漂白性,所以不能用pH试纸测氯水pH值,故错误;
D.使用容量瓶配制溶液时,俯视刻度线定容后溶液体积偏小,浓度偏大,故正确;
E.向饱和FeCl3溶液中滴加少量NaOH溶液,不可制取Fe(OH)3胶体,得到的是氢氧化铁沉淀,向沸水中滴加几滴饱和氯化铁溶液再加热至沸腾得到氢氧化铁胶体,故错误;
F.苯的密度小于水,所以苯在上方、水在下方,从分液漏斗上口放出将溴的苯溶液,故错误;
故选BD;
(2)①该装置属于固液混合不加热型装置,实验室可以用双氧水和二氧化锰制取氧气、用高锰酸钾和浓盐酸制取氯气、用浓氨水和碱石灰或氧化钙或氢氧化钠制取氨气,故答案为:
| O2 | Cl2 | NH3 |
| 浓盐酸 | ||
| 过氧化钠 | 碱石灰或氧化钙或氢氧化钠 |
③可以用NaOH溶液除去氯气,氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,离子方程式为Cl2+2OH-═ClO-+Cl-+H2O;氨气极易溶于水会产生倒吸现象,所以不能用稀硫酸吸收氨气,有缓冲装置的能防止倒吸,四氯化碳密度大于水,如果将四氯化碳与水混合时,水在四氯化碳上方,该装置能起到缓冲作用,防止倒吸,
故答案为:Cl2+2OH-═ClO-+Cl-+H2O;氨气极易溶于水(稀硫酸);会引起倒吸;CCl4(或四氯化碳).
点评:本题考查实验方案评价,涉及气体的制取、收集、除杂等知识点,根据物质状态及反应条件确定反应装置、根据气体性质及密度确定收集装置,注意有毒或有刺激性气味气体尾气处理方法,知道氧气、氢气、二氧化碳、氯气等气体的制取、收集原理,题目难度不大.

练习册系列答案
相关题目
在指定条件下,下列各组离子一定能够大量共存的是( )
| A、能使甲基橙变黄的溶液中:Al3+、Na+、SO42-、CO32- | ||
| B、能与铝反应产生氢气的溶液:Na+、Fe2+、Cl-、NO3- | ||
C、
| ||
| D、由水电离的c(H+)=1.0×10-13 mol?L-1的溶液中:K+、NH4+、AlO2-、HCO3- |
A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数.A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是( )
| A、B元素原子的电子排布式为1S22S22P63S23P5 |
B、化合物AB的电子式为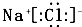 |
C、化合物AB的电子式为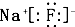 |
| D、A与水反应的离子方程式为Na+H2O═OH-+Na++H2 |