题目内容
将11.9g Mg、Al、Fe组成的合金溶于足量NaOH溶液中,产生的气体在标准状况下体积为3.36L.另取等质量合金溶于过量稀硝酸中,生成NO气体,向反应后的溶液中加入过量NaOH溶液,得到沉淀19.4g,则上述反应中生成NO气体的体积为(标准状况下)( )
| A、6.72 L |
| B、11.2 L |
| C、22.4 L |
| D、4.48 L |
考点:有关混合物反应的计算
专题:计算题
分析:只有Al与氢氧化钠溶液反应生成氢气,根据电子转移守恒计算n(Al),进而计算Al的质量,可得混合物中Mg、Fe总质量.将合金溶于过量稀硝酸中,分别生成Al3+、Fe3+、Mg2+离子,向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化镁,由电荷守恒可知,反应中金属Mg、Fe提供的电子的物质的量等于沉淀中氢氧根离子的物质的量,沉淀的质量等于Fe、Mg的总质量与氢氧根质量之和,从而求出反应中金属Fe、Mg失去电子的物质的量,再根据电子转移守恒计算NO的物质的量,进而计算NO的体积.
解答:
解:合金溶于足量的NaOH溶液中,只有铝和氢氧化钠反应产生气体氢气3.36L(标准状况),氢气物质的量=
=0.15mol,根据电子转移守恒,则n(Al)=
=0.1mol,故m(Al)=0.1mol×22.4L/mol=2.7g,则混合物中Mg、Fe总质量=11.9g-2.7g=9.2g,
向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化镁,故沉淀中m(OH-)=19.4g-9.2g=10.2g,n(OH-)=
=0.6mol,由电荷守恒可知,反应中金属Fe、Mg提供的电子的物质的量等于沉淀中氢氧根离子的物质的量,根据电子转移守恒,生成NO的物质的量=
=0.3mol,标况下生成NO的体积0.3mol×22.4L/mol=6.72L,
故选A.
| 3.36L |
| 22.4L/mol |
| 0.15mol×2 |
| 3 |
向反应后的溶液中加入过量的NaOH溶液,铝离子全部转化为偏铝酸根离子,不会出现沉淀,所得沉淀为氢氧化铁、氢氧化镁,故沉淀中m(OH-)=19.4g-9.2g=10.2g,n(OH-)=
| 10.2g |
| 17g/mol |
| 0.6mol+0.1mol×3 |
| 3 |
故选A.
点评:本题考查混合物计算,要清楚发生的反应,关键是判断金属Fe、Mg提供的电子的物质的量等于沉淀中氢氧根离子的物质的量,注意守恒思想的应用,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
A、B两元素可形成AB型离子化合物,且阴、阳离子具有相同的电子数.A、B的单质均能与水发生剧烈反应,反应中A单质做还原剂,B单质做氧化剂,则下列表述正确的是( )
| A、B元素原子的电子排布式为1S22S22P63S23P5 |
B、化合物AB的电子式为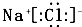 |
C、化合物AB的电子式为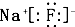 |
| D、A与水反应的离子方程式为Na+H2O═OH-+Na++H2 |
下列有关化学概念或原理的论述中,正确的是( )
| A、任何一个氧化还原反应都可以设计为电池,输出电能 |
| B、铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 |
| C、电解饱和食盐水的过程中,水的电离平衡正向移动 |
| D、任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
下列物质属于纯净物的是( )
| A、液氧 | B、氯水 |
| C、漂白液 | D、碘酒. |
在标准状况下,某烧瓶内装满HCl气体,将此烧瓶倒扣在盛水的水槽内,当液面上升到烧瓶容积的
时,此时烧瓶内溶液的物质的量浓度是( )
| 3 |
| 5 |
| A、0.74mol/L |
| B、0.045mol/L |
| C、0.037mol/L |
| D、0.025mol/L |
根据化学反应的实质是旧键断裂生成这一观点,下列变化不属于化学反应的是( )
| A、石墨转化为金刚石 |
| B、NaOH溶液与盐酸反应生成NaCl和H2O |
| C、NaCl熔化 |
| D、Na2O溶于水 |
同温同压下,同体积的CO和CO2,下列说法不正确的是( )
| A、分子数之比等于2:3 |
| B、原子数之比等于2:3 |
| C、气体物质的量之比等于1:1 |
| D、质量之比等于7:11 |
