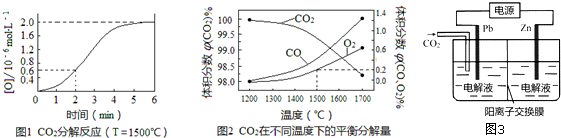
题目内容
10.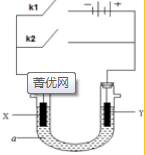 原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:(1)若断开k1,闭合k2,则装置为原电池;X电极上的电极反应式为Fe-2e-
 Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);
Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);(2)若线路中通过3.01×1022的电子,则Y极上析出物质的质量为1.6g.
分析 (1)若断开K1,闭合K2,则形成了原电池,铁(X)为负极,碳棒(Y)为正极,负极铁失去电子生成亚铁离子:Fe-2e-=Fe2+;电解质溶液中的阳离子向正极Y极移动,据此进行解答;
(2)若线路中通过3.01×1022的电子,即0.05mol,则Y极上Cu2++2e-=Cu,析出物质铜的质量为$\frac{0.05×64}{2}$=1.6g.
解答 解:(1)若断开K1,闭合K2,则形成了原电池,铁(X)为负极,碳棒(Y)为正极,负极铁失去电子生成亚铁离子:Fe-2e-=Fe2+;电解质溶液中的阳离子向正极Y极移动,
故答案为:原电池;Fe-2e-=Fe2+;Y;
(2)若线路中通过3.01×1022的电子,即0.05mol,则Y极上Cu2++2e-=Cu,析出物质铜的质量为$\frac{0.05×64}{2}$=1.6g.
故答案为:1.6g.
点评 本题考查了原电池原理原理及其应用,题目难度中等,注意掌握原电池的原理及电子守恒在化学计算中的应用方法.

练习册系列答案
相关题目
20.甲醛、乙酸和葡萄糖组成的混合物中,碳元素的质量分数是( )
| A. | 27% | B. | 52% | C. | 40% | D. | 41.4% |
1.有M、X、Y、Z、W五种原子序数依次增大的短周期主族元素,其中M、Z同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料.下列说法正确的是( )
| A. | X、M两种元素形成的化合物中只能存在离子键 | |
| B. | 元素Z的某种氧化物具有漂白性,是因为这种氧化物具有强氧化性 | |
| C. | 由于W、Z、M元素的氢化物相对分子质量依次减小,所以其沸点依次降低 | |
| D. | 元素W和M的某些单质可作为水处理中的消毒剂 |
5.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现第120号元素,请在“元素大厦”中安排好它的“房间”是( )
| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
2.利用二氧化碳废气生产化工产品是解决室温效应的有效途径之一,对用二氧化碳为主要原料生产的四中产品(如图所示)的相关说法不正确的是 ( )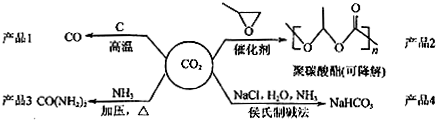

| A. | 反应CO2(g)+C(s)═2CO(g) 的△H>0,△S>0 | |
| B. | 用聚碳酸酯代替聚乙烯等传统塑料,可消除被色污染 | |
| C. | CO(NH2)2与NH4CNO互为同分异构体,两者化学性质相同 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
19.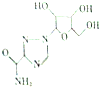 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
 利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )
利巴韦林适用于拉萨热、幼儿呼吸道合胞病毒肺炎、带状咆疹等,其结构简式如图,下列关于利巴韦林的说法错误的是( )| A. | 分子式为C8H12N4O3 | B. | 能使紫色石蕊试液变红 | ||
| C. | 可以发生酯化反应 | D. | 可以与H2发生加成反应 |
2.元素的性质随着原子序数的递增呈现周期性变化的主要原因是( )
| A. | 元素原子的核外电子排布呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的金属性、非金属性呈周期性变化 | |
| D. | 元素的原子半径呈周期性变化 |