题目内容
5.元素周期表是一座开放的“元素大厦”,“元素大厦”尚未客满.若发现第120号元素,请在“元素大厦”中安排好它的“房间”是( )| A. | 第七周期0族 | B. | 第六周期第IA族 | C. | 第八周期第ⅡA族 | D. | 第七周期第ⅦA族 |
分析 若第七周期排满,稀有气体的原子序数为118,可知120号元素位于第八周期,以此来解答.
解答 解:若第七周期排满,稀有气体的原子序数为118,120-118=2,可知120号元素位于第八周期第ⅡA族,
故选C.
点评 本题考查元素周期表结构及应用,为高频考点,把握稀有气体的原子序数推断元素的位置为解答的关键,注意第七周期稀有气体的原子序数,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列关于原电池的说法正确的是( )
| A. | 在正极上发生氧化反应 | B. | 化学性质较活泼的金属为负极 | ||
| C. | 在外电路,电子流出正极 | D. | 是由电能转化为化学能的装置 |
16.设NA为阿伏加德罗常数的值,下列叙述中指定粒子数目一定小于NA的是( )
| A. | 含1molNa2CO3的溶液中CO32-的微粒数目 | |
| B. | 常温常压下,22.4 L N2的原子数目 | |
| C. | 46gNO2和N2O4的混合气体中的原子数 | |
| D. | 28g铁在反应中作还原剂时,失去电子的数目 |
13.元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语.下列有关化学用语的表示方法中正确的是( )
| A. | 硫原子的原子结构示意图: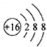 | |
| B. | NH4Cl的电子式: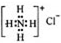 | |
| C. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 用电子式表示氯化氢分子的形成过程: |
17.某小组同学在实验室研究Al与CuCl2溶液的反应.
(1)现象ⅰ中的红色物质是Cu.
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
| 实验操作 | 实验现象 |
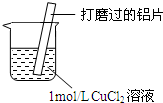 | ⅰ.红色物质附着于铝片表面 ⅱ.大量无色气体从红色物质表面逸出,放出大量的热 ⅲ.烧杯底部出现白色沉淀 |
(2)经检验现象ⅱ中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因Cu2++2H2O?Cu(OH)2+2H+.
②氢气从红色物质表面逸出的原因是Cu和Al在酸性条件下形成原电池,Cu为正极,H+在正极表面得电子生成氢气.
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液…
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是加入足量的稀硝酸,再滴加几滴硝酸银溶液.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因CuCl在水溶液中存在平衡:CuCl(s)?Cu+(aq)+Cl-(aq),加入浓氨水,浓氨水与Cu+反应生成Cu(NH3)2+,Cu+浓度减小,平衡正向移动,促进CuCl溶解.
(4)探究CuCl产生的原因.
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有还原性.
②取Cu粉与1mol/L CuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是加热.
14.下列有关NH4Al(SO4)2溶液的叙述正确的是( )
| A. | 0.1mol/L的该溶液中含有0.2NA个SO42- | |
| B. | 该溶液中Cu2+、H+、NO3-可以大量共存 | |
| C. | 滴入Ba(OH)2溶液恰好使SO42-完全沉淀的离子方程式为:2Ba2++Al3++2SO42-+4OH-═AlO2-+2BaSO4↓+2H2O | |
| D. | 该溶液加热蒸干后得到Al2O3固体 |
17.要检验某溴乙烷中的溴元素,正确的实验方法是( )
| A. | 加入氯水振荡,观察水层是否有棕红色出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸使溶液呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
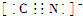 ,1mol O22+中含有的π键数目为2NA.
,1mol O22+中含有的π键数目为2NA.
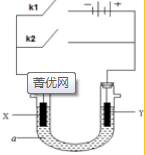 原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题:
原电池与电解池在化学工业中有广泛应用.如图装置,a为CuCl2溶液,X为Fe棒,Y为碳棒,回答以下问题: Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);
Fe2+;电解质溶液中的阳离子向Y极移动(填X或Y);