题目内容
天津是我国研发和生产锂离子电池的重要基地.锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示.电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是( )
| ||
| 放电 |
| A、上述反应为可逆反应 |
| B、放电时,电池的正极反应为CoO2+Li++e-=LiCoO2 |
| C、锂离子电池可以用水溶液来做电解质溶液 |
| D、锂离子电池的比能量(单位质量释放的能量)低 |
考点:化学电源新型电池
专题:电化学专题
分析:由电解池的总反应来确定充放电时的电极反应,由于单质锂较活泼,易与水之间发生反应,所以不可以用水溶液来做电解质溶液,根据二次电池的工作原理来回答判断即可.
解答:
解:A、充电和放电是条件不一样的两个过程,不是可逆反应,故A错误;
B、放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,故B正确;
C、由于单质锂较活泼,易与水反应而变质,电解质不能用水溶液来做电解质溶液,故C错误.
D、锂离子电池的比能量高,故D错误.
故选B.
B、放电时,电池的正极发生得电子的还原反应,CoO2+Li++e-=LiCoO2,故B正确;
C、由于单质锂较活泼,易与水反应而变质,电解质不能用水溶液来做电解质溶液,故C错误.
D、锂离子电池的比能量高,故D错误.
故选B.
点评:本题考查学生二次电池的工作原理知识,注意知识的归纳和整理是解题关键,难度不大.

练习册系列答案
相关题目
下列说法错误的是( )
| A、需要加热才能发生的反应不一定是吸热反应 |
| B、放热反应在常温下一定很容易发生 |
| C、反应是放热还是吸热取决于反应物和生成物所具有的总能量的相对大小 |
| D、吸热的反应在常温下也可能发生 |
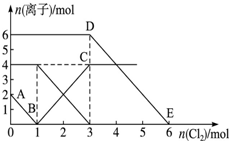 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.已知:Cl2+2Br-═2Cl-+Br2,2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.则下列说法中不正确的是( )| A、还原性:I->Fe2+>Br- |
| B、原混合溶液中FeBr2的物质的量为3mol |
| C、线段AB表示Fe2+被氯气氧化 |
| D、原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
用价层电子对互斥理论(VSEPR)可以预测许多分子或离子的空间构型,有时也能用来推测键角大小,下列判断正确的是( )
| A、SO2、CS2、HI都是直线形的分子 |
| B、BF3键角为120°,SnBr2键角大于120° |
| C、COCl2、BF3、SO3都是平面三角形的分子 |
| D、PCl3、NH3、PCl5都是三角锥形的分子 |
称量烧碱时,烧碱必须( )
| A、直接放在托盘上 |
| B、放在滤纸上 |
| C、放在烧杯上 |
| D、放在称量纸上 |
在标准状况下,若8g气体A和22g CO2所含分子数相等,则气体A的密度为( )
| A、0.714g/mL |
| B、0.714g/L |
| C、0.179g/L |
| D、0.275g/L |
下列有关CuSO4?5H2O的叙述正确的是( )
| A、1mol CuSO4?5H2O的质量为250g/mol |
| B、CuSO4?5H2O的摩尔质量为250g |
| C、CuSO4?5H2O的摩尔质量为250g/mol |
| D、配制100mL 0.1mol/L 硫酸铜溶液需要CuSO4?5H2O 1.6g |